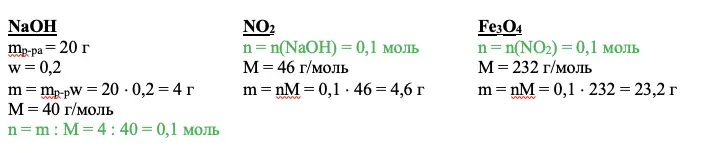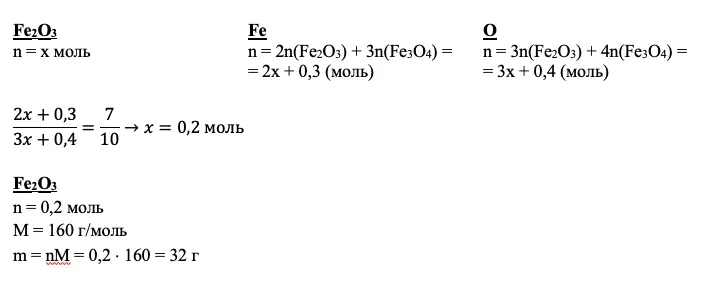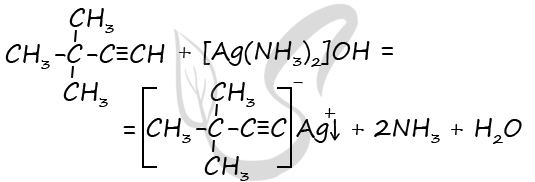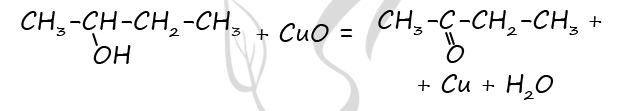Задания 33 (2017). Реакции, подтверждающие взаимосвязь органических соединений.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Пояснение:
1) Получить ацетилен из 1,2-дибромэтана можно, подействовав на него спиртовым раствором щелочи при нагревании. При этом от одной молекулы дибромэтана отщепляются две молекулы бромоводорода, которые нейтрализуются щелочью:
2) Гидратация ацетилена протекает в присутствии солей ртути и приводит к образованию ацетальдегида (реакция М.Г. Кучерова):
3) Дихромат калия в присутствии серной кислоты превращает ацетальдегид в уксусную кислоту:
4) Гидрокарбонаты аналогично карбонатам вступают в реакцию обмена с растворами кислот:
5) Ацетаты щелочноземельных металлов при нагревании вступают в реакцию разложения, в результате которой образуется карбонат металла и кетон:
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Пояснение:
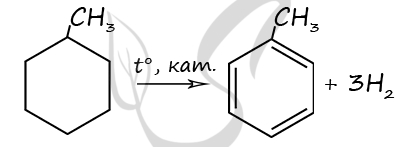
1) Под действием катализаторов гидрирования/дегидрирования (платина, никель, палладий) алканы с длиной углеродной цепи более 6-ти атомов при нагревании могут вступать в реакцию дегидроциклизации:
2) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При хлорировании этилбензола на свету замещение происходит не в ароматическом ядре, а в боковой цепи. При этом замещение атомов водорода происходит преимущественно у вторичного, а не первичного углеродного атома:
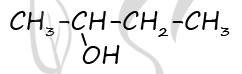
4) Моногалогенпроизводные углеводородов при действии водных растворов щелочей вступают в реакцию замещения. При этом образуются спирты соответствующего строения:
5) 1-фенилэтанол при действии таких окислителей, как перманганат калия или дихромат калия в присутствии серной кислоты может окислиться до кетона, либо до бензойной кислоты и углекислого газа. Любой вариант из двух записанных ниже реакций засчитывался на экзамене:
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Пояснение:
1) При действии на гомологи бензола хлора или брома на свету галогенированию подвергается боковая цепь. При этом в случае этилбензола замещение атома водорода будет происходить преимущественно у вторичного атома углерода:
* Напомним, что для того чтобы замещение атома водорода атомом галогена происходило в ароматическом ядре, а не боковой цепи, галогенирование следует проводить в присутствии соответствующего галогенида алюминия или трехвалентного железа.
1) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
Если бы раствор щелочи был водным, то вместо указанной реакции произошло бы замещение атома галогена в галогенпроизводном на гидроксильную группу.
3) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон:
4) Бензойная кислота реагирует с раствором гидрокарбоната (как и карбоната) натрия, поскольку является более сильной, чем образующаяся нестойкая угольная:
5) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При гидрировании бутадиена-1,3 и изопрена протекает преимущественно так называемое 1,4-присоединение:
2) Действие на алкены подкисленного раствора перманганата или дихромата относят к так называемому жесткому окислению. При таком окислении углеродный скелет молекулы алкена претерпевает полный разрыв по месту двойной связи. При этом в зависимости от замещенности атома углерода при двойной связи возможно образование трех различных продуктов. Так, первичные атомы углерода при двойной связи переходят в молекулы углекислого газа, вторичные атомы углерода при двойной связи — в карбоновые кислоты, а третичные — в кетоны. В нашем случае оба атома углерода при двойной связи являются вторичными:
3) Хлорирование карбоновых кислот на свету либо в присутствии красного фосфора при нагревании приводит преимущественно к замещению атомов водорода при атоме углерода в α-положении:
4) Действием на галогенпроизводные карбоновых кислот избытка аммиака получают соответствующие аминокислоты:
5) Аминокислоты реагируют с щелочами с образованием солей:
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Сложные эфиры могут вступать в реакции гидролиза. При этом при действии на сложные эфиры растворов щелочей гидролиз протекает необратимо и приводит к образованию соли карбоновой кислоты и спирта:
* Следует отметить, что сложные эфиры могут также состоять из остатков карбоновых кислот и фенолов. При щелочном гидролизе таких эфиров образуются две соли — соль карбоновой кислоты и фенолят активного металла.
2) Соли, состоящие из остатков карбоновых кислот и катионов щелочноземельных металлов, при нагревании вступают в реакцию декарбоксилирования — образуются соответствующие карбонат двухвалентного металла и кетон:
3) Кетоны легко гидрируются в присутствии катализаторов (Pt, Pd, Ni) до соответствующих вторичных спиртов:
4) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
5) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
[adsp-pro-3]
Задание №6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Альдегиды способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий):
2) Спирты реагируют с галогеноводородными кислотами, образуя соответствующие галогенпроизводные:
3) Бензол и его гомологи можно алкилировать хлор- или бромалканами (кат. — соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
4) Ароматические углеводороды вступают в реакцию нитрования при действии на них смеси концентрированных серной и азотной кислот (нитрующей смеси). В нашем случае, поскольку алкильные заместители (метил, этил и т.д.) являются заместителями первого рода, последующий заместитель направляется в орто- и пара-положения по отношению к исходному. Т.е. образуется смесь орто— и пара-нитротолуолов. Исходя из цепочки задания, нам следует записать уравнение реакции с образованием пара-изомера:
5) Нитропроизводные углеводородов восстанавливаются металлами до водорода в кислой среде. При этом происходит восстановление нитросоединений до солей аминов:
Задание №7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600оС протекает реакция тримеризации:
2) Бензол и его гомологи можно алкилировать хлор- или бромалканами (кат. — соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При действии на гомологи бензола хлора или брома на свету галогенированию подвергается боковая цепь:
4) При щелочном гидролизе геминальных дигалогенпроизводных образуются альдегиды или кетоны:
5) Альдегиды под действием таких окислителей, как гидроксид меди (II), перекись водорода, а также подкисленные растворы перманганатов и дихроматов превращаются в соответствующие карбоновые кислоты:
Задание №8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Спирты при нагревании с концентрированной серной кислотой могут вступать в реакцию внутримолекулярной дегидратации, приводящей к образованию алкенов:
2) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
3) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
4) Действие спиртового раствора щелочи на вицинальные и геминальные дигалогенпроизводные алканов приводит к образованию алкинов:
5) Алкины, в молекулах которых обнаруживается фрагмент H-C≡, в отличии от других алкинов способны вступать в реакцию замещения с аммиачным раствором оксида серебра. В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи. Поскольку в молекуле ацетилена при тройной C≡C связи имеется сразу два атома водорода, в зависимости от пропорции между реагирующими веществами могут замещаться либо два, либо один атом водорода. В обоих случаях наблюдается выпадение осадка соли серебра:
Задание №9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
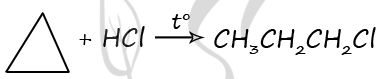
1) Действие на 1,3-дибромпропан цинковой пыли приводит к образованию циклопропана:
2) В циклоалканах с малым размером цикла (3 и 4 углеродных атома) в связи с малыми значениями валентных углов С-С-С имеется сильное напряжение внутри молекулы. Такие соединения легко вступают в реакцию присоединения с водородом, галогенами и галогеноводородами подобно алкенам:
* В отличие от алкенов циклоалканы не реагируют с водой и водным раствором перманганата калия.
3) Действие на моногалогеналканы спиртового раствора щелочи
4) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон. В нашем случае один из атомов углерода при двойной связи — вторичный, а второй — первичный:
5) Карбоновые кислоты реагируют с карбонатами и гидрокарбонатами, вытесняя из них более слабую угольную кислоту:
Задание №10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
2) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
3) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
4) Действие спиртового раствора щелочи на вицинальные и геминальные дигалогенпроизводные алканов приводит к образованию алкинов:
5) Алкины, в молекулах которых обнаруживается фрагмент H-C≡, в отличии от других алкинов способны вступать в реакцию замещения с аммиачным раствором оксида серебра. В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи:
[adsp-pro-3]
Задание №11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии воды на карбид кальция протекает реакция обмена, одним из продуктов которой является ацетилен:
2) Ацетилен в присутствии солей ртути вступает в реакцию гидратации:
3) Альдегиды легко окисляются до карбоновых кислот или их солей. В карбоновые кислоты альдегиды могут быть превращены действием таких реагентов, как Cu(OH)2, H2O2, подкисленные растворы K2Cr2O7 или KMnO4:
4) Любые кислоты, в том числе органические, реагируют с щелочами, образуя соль и воду:
5) При сплавлении твердых соли карбоновой кислоты и щелочи протекает реакция декарбоксилирования:
Задание №12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600оС протекает реакция тримеризации:
2) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При действии на бензол и его гомологи брома или хлора в присутствии галогенидов алюминия или железа (III) галогенированию подвергается ароматическое ядро. В нашем случае, поскольку алкильные заместители (метил, этил и т.д.) являются заместителями первого рода, последующий заместитель направляется в орто- и пара-положения по отношению к исходному. Т.е. образуется смесь орто— и пара-бромтолуолов. Исходя из цепочки задания, нам следует записать уравнение реакции с образованием пара-изомера:
4) При смешении п-бромтолуола с бромметаном и натрием протекает реакция Вюрца-Фиттига:
5) Гомологи бензола, представляющие собой метилзамещенный бензол, при действии подкисленного раствора перманганата калия окисляются до карбоновой кислоты. При этом
Задание №13
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Нагревание метана до 1200-1500 oC приводит к образованию ацетилена и водорода:
2) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600оС протекает реакция тримеризации:
3) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
4) При действии на толуол раствора перманганата калия в кислой среде образуется бензойная кислота, а в нейтральной или щелочной — соль бензойной кислоты:
5) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
Задание №14
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии хлора или брома на алканы при ультрафиолетовом облучении протекает реакция замещения с образованием галогеналкана и соответствующего галогеноводорода. В зависимости от от пропорции галоген/алкан замещаться на галоген может один или более атомов водорода:
2) При действии натрия на моногалогеналканы протекает реакция Вюрца:
3) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана. При этом атом водорода замещается преимущественно у наиболее замещенного атома углерода, в нашем случае — вторичного:
4) При действии на галогенпроизводные углеводородов спиртовых растворов щелочей при нагревании протекает реакция дегидрогалогенирования:
5) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон:
Задание №15
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Любые кислоты, в том числе органические, реагируют с щелочами, образуя соль и воду:
2) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
3) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
4) При действии на изопропилбензол (кумол) хлора или брома в реакцию замещения вступает боковая цепь ароматического углеводорода. При этом, как и в случае алканов, замещению подвергается атом водорода при наиболее замещенном атоме углерода, в нашем случае — третичном:
5) При действии на моногалогенпроизводные углеводоводородов водного раствора щелочей протекает реакция замещения, органическим продуктом которой является одноатомный спирт соответствующего строения:
[adsp-pro-3]
Задание №16
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При нагревании алканов в присутствии таких катализаторов, как платина, никель, палладий или оксид хрома (III) можно осуществлять реакцию дегидрирования:
2) Алкены при действии на них галогенов вступают в реакцию присоединения, образуя вицинальные дигалогеналканы:
3) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
4) При действии на пропин катализаторов при нагревании протекает реакция, аналогичная тримеризации ацетилена. При этом из-за пространственных (стерических) ограничений из пропина образуется исключительно 1,3,5-триметилбензол. Грубо говоря, три метильных радикала «мешают» друг другу, в результате чего расположатся на максимальном удалении друг от друга в образующемся ароматическом углеводороде:
5) При действии на метилзамещенные бензолы перманганата или дихромата калия в кислой среде все метильные радикалы превращаются в карбоксильные группы:
Задание №17
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Гидратация ацетилена протекает в присутствии солей ртути и приводит к образованию ацетальдегида (реакция Кучерова):
* Гомологи ацетилена в этих же условиях вместо альдегида образуют кетон.
2) Дихромат калия в присутствии серной кислоты превращает ацетальдегид в уксусную кислоту:
3) Органические кислоты подобно неорганическим реагируют с основными оксидами, образуя соль и воду:
4) Ацетаты щелочноземельных металлов при нагревании вступают в реакцию декарбоксилирования, в результате которой образуется карбонат металла и кетон:
5) Кетоны способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий). Результатом такой реакции является образование вторичного спирта:
Задание №18
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Альдегиды способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий). Результатом такой реакции является образование первичного спирта:
2) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
3) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
4) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
5) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
Задание №19
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии на альдегиды нейтрального либо щелочного раствора перманганата калия они окисляются, образуя соли карбоновых кислот соответствующего строения:
2) При проведении электролиза растворов солей карбоновых кислот происходит образование углеводорода, углекислого газа, водорода и щелочи:
3) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана:
4) При действии на галогенпроизводные углеводородов спиртовых растворов щелочей при нагревании протекает реакция дегидрогалогенирования:
5) Алкены при действии на них галогенов вступают в реакцию присоединения, образуя вицинальные дигалогеналканы:
Задание №20
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии на моногалогенпроизводные углеводоводородов водного раствора щелочей протекает реакция замещения, органическим продуктом которой является одноатомный спирт соответствующего строения:
2) Первичные спирты действием перманганата или дихромата калия в кислой среде могут быть окислены до альдегидов либо до карбоновых кислот:
3) Хлорирование карбоновых кислот на свету либо в присутствии красного фосфора при нагревании приводит преимущественно к замещению атомов водорода при атоме углерода в α-положении:
4) Карбоновые кислоты реагируют с карбонатами и гидрокарбонатами, вытесняя более слабую угольную кислоту, которая будучи нестойкой разлагается на углекислый газ и воду
5) Действием галогенпроизводных на соли, образованные щелочными металлами и карбоновыми кислотами, могут быть получены сложные эфиры:
[adsp-pro-3]
Задание №21
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Этилбензол при действии подкисленного раствора дихромата или перманганата калия окисляется с образованием бензойной кислоты и углекислого газа:
2) Карбоновые кислоты реагируют с щелочами с образованием соответствующих солей и воды:
3) При сплавлении соли карбоновой кислоты с твердой щелочью протекает реакция декарбоксилирования, продуктами которой является углеводород и карбонат металла:
4) Ароматические углеводороды вступают в реакцию нитрования при действии на них смеси концентрированных серной и азотной кислот (нитрующей смеси):
5) При действии на нитропроизводные кислот-неокислителей совместно с металлами, расположенными до водорода в ряду активности, происходит восстановление первых до солей аминов:
Задание №22
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана:
2) При действии на моногалогеналканы натрия протекает реакция Вюрца:
3) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана. При этом атом водорода замещается преимущественно у наиболее замещенного атома углерода, в нашем случае — вторичного:
4) При действии на галогенпроизводные углеводородов спиртовых растворов щелочей при нагревании протекает реакция дегидрогалогенирования:
5) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон. В нашем случае оба атома углерода при двойной связи являются вторичными, поэтому переходят после окисления в состав карбоксильных групп молекул карбоновых кислот:
Задание №23
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии хлора на бензол при нагревании в присутствии катализаторов (AlCl3 или FeCl3) протекает реакция замещения с образованием хлорбензола:
2) При смешении хлорбензола с хлорметаном и натрием протекает реакция Вюрца-Фиттига:
3) В нашем случае, поскольку алкильные заместители (метил, этил и т.д.) являются заместителями первого рода, последующий заместитель направляется в орто— и пара-положения по отношению к исходному. Т.е. образуется смесь орто— и пара-нитротолуолов. Исходя из цепочки задания следует, что нам нужно записать уравнение реакции с образованием пара-изомера:
4) Нитропроизводные углеводородов восстанавливаются металлами до водорода в кислой среде. При этом происходит восстановление первых до солей аминов:
5) Соли, образованные аминами, так же, как и соли аммония, могут реагировать с другими растворимыми солями, если образуется осадок:
[adsp-pro-10]
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник: ЕГЭ по химии 20.06.2016. Основная волна. Вариант 46 (Часть С)
2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
Источник: ЕГЭ по химии 2020. Основная волна. Центр. Задания C
3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник: Задания 33 ЕГЭ–2021 по химии
4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник: ЕГЭ по химии 2017. Досрочная волна
5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник: ЕГЭ по химии 2016. Основная волна (Часть С)
Пройти тестирование по этим заданиям
-
Типы задач в задании 33.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Дополнение по определению структурной формулы:
-
Ответы и комментарии к задачам для самостоятельного решения.
Автор статьи — профессиональный репетитор О. В. Овчинникова.

- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки при написании требуемых уравнений реакций с участием найденного вещества.
к оглавлению ▴
Типы задач в задании 33.
- 1. Определение молекулярной формулы вещества по массовым долям химических элементов или по общей формуле вещества, а затем его структурной формулы по химическим свойствам;
- 2. Определение молекулярной формулы вещества по продуктам сгорания, а затем его структурной формулы по химическим свойствам.
Стоит отметить, что во всех подобных заданиях ЕГЭ требуется написать уравнение реакции, в котором принимает участие искомое вещество. Так что знание реакций тоже необходимо.
к оглавлению ▴
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе составасодержится
атома углерода и
атома водорода. Если взять
молекулу такого вещества, то его молекулярная масса будет равна:
а.е.м. и там содержится
а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
или
Если вещество имеет общую формулу
, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса
атомов
равна
, масса
атомов
, масса
атомов кислорода
Тогда
Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например,
— истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение, т.е. простейшая формула бензола —
.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол Бутен Уксусная кислота Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа
по газу
Относительная плотность
— это величина, которая показывает, во сколько раз газ
тяжелее газа
. Её рассчитывают как отношение молярных масс газов
и
:
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа
по водороду:
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за
г/моль (исходя из примерного усреднённого состава).
Поэтому: - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса
л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
Если взять
моль газа, то тогда:
,
а молярную массу газа можно найти, умножая плотность на молярный объём.
- Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы — Алкены Алкины Диены — Гомологи бензола Предельные одноатомные спирты Многоатомные спирты Предельные альдегиды Кетоны Фенолы Предельные карбоновые кислоты Сложные эфиры Амины Аминокислоты (предельные одноосновные)
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
-
Пример 1.
Определить формулу вещества, если оно содержити
и имеет относительную плотность по воздуху, равную
.
Решение примера 1.
- Пусть масса вещества равна
г. Тогда масса
будет равна
г, а масса
г.
- Найдём количество вещества каждого атома:
моль,
моль.
- Определяем мольное соотношение атомов
и
:
(сократим оба числа на меньшее)
(домножим на
)
Таким образом, простейшая формула
. Однако вещества с такой формулой не существует. Для нахождения молекулярной формулы нам потребуется домножать простейшую формулу на небольшие числа: 2, 3 и т. п. Например при домножении эмпирической формулы на 2 мы получаем алкан, имеющий в своём составе 8 атомов углерода:
.
Чтобы проверить, правильна ли найденная нами формула, необходимо использовать дополнительные данные, которые всегда указаны в задаче. Это могут быть либо химические свойства вещества, либо информация, позволяющая вычислить его молярную массу. В данном случае дана относительная плотность соединения по воздуху. - По относительной плотности рассчитаем молярную массу:
г/моль.
Молярная масса, соответствующая простейшей формуле
г/моль, это в
раза меньше истинно молярной массы.
Значит, истинная формула
.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу ( г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
т.е. число атомов
т.е число атомов
Формула вещества .
-
Пример 2.
Определить формулу алкина с плотностьюг/л при нормальных условиях.
Решение примера 2.
Общая формула алкина
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность — это масса
литра газа при нормальных условиях.
Так как моль вещества занимает объём
л, то необходимо узнать, сколько весят
л такого газа:
плотность
молярный объём
г/л
л/моль =
г/моль.
Далее, составим уравнение, связывающее молярную массу и :
Значит, алкин имеет формулу
-
Пример 3.
Определить формулу предельного альдегида, если известно, чтомолекул этого альдегида весят
г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в моль вещества.
Это число Авогадро: (молекул).
Значит, можно найти количество вещества альдегида:
моль,
и молярную массу:
г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим .
Общая формула предельного альдегида , то есть
.
-
Пример 4.
Определить формулу дихлоралкана, содержащегоуглерода.
Решение примера 4.
Общая формула дихлоралкана: , там
атома хлора и
атомов углерода.
Тогда массовая доля углерода равна:
число атомов
в молекуле
атомная масса
молекулярная масса дихлоралкана
вещество — дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось
г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) —
Тогда схема реакции сгорания выглядит так:
Нетрудно заметить, что при сгорании
моль алкана выделится
моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
моль.
- При пропускании углекислого газа через известковую воду
выпадает осадок карбоната кальция:
Масса осадка карбоната кальция —
г, молярная масса карбоната кальция
г/моль.
Значит, его количество вещества
моль.
Количество вещества углекислого газа тоже
моль.
- Количество углекислого газа в
раза больше чем алкана, значит формула алкана
.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна. При сжигании
г этого соединения образуется
л углекислого газа (н. у) и
г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов и, возможно,
. Поэтому его общую формулу можно записать как
.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду.
- Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
моль.
На одну молекулу
приходится один атом
, значит, углерода столько же моль, сколько
.
моль
моль.
В одной молекуле воды содержатся два атома
, значит количество водорода в два раза больше, чем воды.
моль.
- Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
- Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
Простейшая формула
.
- Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул
и его молярная масса
г/моль):
г/моль.
Истиная формула
, её молярная масса
.
Истинная формула
.
-
Пример 7.
Определите молекулярную формулу вещества, при сгоранииг которого образовалось
г
г воды и азот. Относительная плотность этого вещества по водороду —
. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы
и
. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения: - Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
- Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
г ,
моль.
Простейшая формула —
Истинная молярная масса
г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
-
Пример 8.
Вещества содержити
. При сгорании
г его выделилось
г
г
, а сера была полностью переведена в сульфат бария, масса которого оказалась равна
г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
моль.
моль.
моль.
моль.
моль.
моль.
- Рассчитываем предполагаемую массу кислорода в исходном веществе:
- Находим мольное соотношение элементов в веществе:
Формула вещества
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы
получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветитьг
-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов —
.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с
моль диена вступят
моль брома:
- Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
г
моль.
- Так как количество брома, вступившего в реакцию, в
раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через
:
Это пентадиен
.
-
Пример 10.
При взаимодействииг предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования
мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта —
Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой
.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
- Находим молярную массу спирта и
:
Спирт — бутанол
.
-
Пример 11.
Определить формулу сложного эфира, при гидролизег которого выделяется
г спирта и
г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
Соответственно, спирт будет иметь формулу
,
а кислота
.
Уравнение гидролиза сложного эфира:
- Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
= (масса кислоты) + (масса спирта) − (масса эфира) =
г
моль
Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:
г/моль,
г/моль.
Получим два уравнения, из которых найдём
и
:
— уксусная кислота
— этанол.
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
-
Пример 12.
Определить формулу аминокислоты, если при действии наг её избытком гидроксида натрия можно получить
г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно.
- Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что
.
Можно это сделать математически, если принять, что
.
.
Это аланин — аминопропановая кислота.
Однако на данном этапе решение задачи не заканчивается. В ней требуется установить и структурную формулу вещества. Вот пример подобного задания:
При сгорании 5,8 г органического вещества образуется 6,72 л углекислого газа и 5,4 г воды. Плотность паров этого вещества по воздуху равна 2.
Установлено, что это вещество не взаимодействует с аммиачным раствором оксида серебра, но каталитически восстанавливается водородом с образованием вторичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты и углекислого газа. На основании этих данных:
1) установите простейшую формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с водородом.
(источник: Типовые тестовые задания по химии, под редакцией Ю. Н. Медведева. 2015 г.)
В первой части задачи в результате вычислений мы находим молекулярную формулу соединения: C3H6O. Затем начинаем путём логических размышлений находить структурную формулу. Общая формула CnH2nO характерна для альдегидов и кетонов, так же возможно предположить спирт: пропен-2-ол-1 (напомним: соединение с гидроксильной группы у атома углерода, образующего двойную связь является неустойчивым). Во-первых, данное вещество не подвергается окислению аммиачным раствором оксида серебра, значит, это не альдегид. Во-вторых, данное вещество каталитически восстанавливается водородом с образованием вторичного спирта, а значит, это не спирт. Единственный оставшийся вариант – кетон, а именно – ацетон. Подтверждает это и возможность окисления соединения кислым перманганатом калия до углекислого газа и карбоновой кислоты. Написание уравнения реакции уже не должно вызвать затруднений.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна г/л. Массовая доля углерода в нем равна
. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна , массовая доля азота равна
. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна . Выведите молекулярную формулу карбоновой кислоты.
1–4. л алкадиена при н.у. имеет массу, равную
г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна . При сжигании
г этого вещества образуется
г углекислого газа (н.у.) и
г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой г в избытке кислорода получили
г азота,
л (н.у.)
и
г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится
молекул.
2–3. Углекислый газ, полученный при сгорании г углеводорода, пропустили через избыток раствора гидроксида кальция и получили
г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего и хлор, выделилось
л (н.у.) углекислого газа,
г воды,
г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось л (н.у.) углекислого газа,
г воды и
л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он г его при присоединении воды образуют
г спирта.
3–2. Для окисления г предельного альдегида до кислоты потребовалось
г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой г с избытком бромоводорода образует
г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой г с избытком калия выделилось
л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили г альдегида,
г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Дополнение по определению структурной формулы:
Д-1. Дана молекулярная формула: C2H6O. Искомое вещество газообразно при н. у., не реагирует с металлическим натрием и может быть получено дегидратацией спирта. Установите его структурную формулу.
Д-2. Дана молекулярная формула: C3H8O2. Искомое вещество реагирует с натрием, а при дегидратации под действием серной кислоты превращается в соединение, содержащее шестичленный цикл. Установите его структурную формулу.
Д-3. Дана молекулярная формула: C2H7NO. Искомое вещество представляет собой бесцветную, вязкую жидкость с запахом аммиака. Оно реагирует и с натрием, и с азотистой кислотой, причём в обоих случаях выделяется газ. Установите его структурную формулу.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1.
1–2.
1–3.
1–4.
1–5. — формиат кальция, соль муравьиной кислоты
2–1.
2–2.
2–3. (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. (не забудьте, что атомы водорода содержатся не только в воде, но и в
)
2–5.
3–1.
3–2.
3–3.
3–4.
3–5.
Д–1.
Д–2.
Д–3.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Задача 33 на ЕГЭ по химии. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.03.2023
Ни для кого не секрет, что задача 33 (она же бывшая задача 34) в ЕГЭ по химии — самое сложное задание, а судя по статистике (только 8,3% выпускников справляются с ним), она еще и практически невыполнимая. Поэтому значительное число выпускников даже не читают условие этой задачи. А зря. Если вы пришли на экзамен по химии, то уж точно сможете записать несколько уравнений, ведь так?
Задача 33 по химии: суть и критерии оценивания
Задание № 33 в ЕГЭ по химии — это расчетная задача высокого уровня сложности. Чтобы успешно решить ее, вам необходимо знать химические свойства веществ, уметь устанавливать логические связи между реакциями, применять расчетные формулы для нахождения количества вещества, массы и объема, массовой доли вещества в смеси.
Для получения максимально возможных 4 баллов за задачу 33 вам предстоит:
- записать все уравнения реакций, описанных в тексте (1 балл);
- рассчитать количества вещества всех известных и искомых веществ (1 балл);
- провести анализ и рассчитать искомые величины (1 балл);
- дать правильный ответ и безошибочно оформить решение (1 балл; снимается за отсутствие размерных величин — больше трех, также за математические ошибки)
Но слова в сторону, нам нужна успешная пошаговая стратегия: что делать, чтобы не получить за этот номер 0?
ЕГЭ по химии — в принципе достаточно сложный экзамен. Чтобы получить за него высокий балл, нужно хорошо постараться. Так, необходимо хорошо знать теорию и формулы, уметь выводить уравнения без ошибок, понимать, как правильно читать задания (в них могут быть ловушки!) и оформлять ответы по критериям. И все это — за ограниченный период времени.
Чтобы не стрессовать на экзамене и показать лучший результат, записывайтесь ко мне на курсы подготовки к ЕГЭ по химии. Мы изучим только то, что гарантированно пригодится вам на экзамене: ничего лишнего, только актуальные знания. А пробные экзамены, которые мы обязательно проводим, помогут понять, что ЕГЭ — совсем не такое страшное. Приходите к нам — за знаниями и спокойствием!
Пошаговый разбор реального задания 33
Уровень «Новичок»
Вы выбрали химию для поступления и готовилист к ЕГЭ минимум год. Вам абсолютно под силу записать уравнения реакций, описанных в тексте. Чаще всего здесь встречаются реакции обмена, замещения и разложения, ОВР, электролиз и совместный гидролиз. Правильно записанные реакции с расставленными коэффициентами дают 1 первичный балл за 33 задачу в ЕГЭ по химии.
ШАГ 1. Запишите все уравнения реакций, о которых идет речь в тексте
Если возможны вариации одной и той же реакции, рассмотрите их на черновике (например, получение средних/кислых солей, образование амфотерного гидроксида/ комплексной соли и т.п.). Какую реакцию оставить, вы поймете после получения первых результатов расчета.
Совет: повторите перед экзаменом тривиальные названия. Например, если вы не знаете, что такое «железная окалина», то ни записать реакцию, ни решить данную задачу не удастся 🙃
Смесь железной окалины и оксида железа III растворяют в азотной концентрированной кислоте. Запишем их по очереди. Железная окалина содержит железо в степени окисления +2, отсюда и протекание окислительно-восстановительной реакции: железо повышает степень окисления до +3, а азот изменяет свою степень окисления с +5 до +4. Вторая реакция представляет собой классическую реакцию обмена:
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Образовавший газ (это NO2, полученный в первой реакции) взаимодействует с гидроксидом натрия:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
ИТОГО: +1 балл
С одним пунктом вы справились. Далее запишите «дано». Баллов за эту запись вам не добавят, но при этом вы сможете увидеть все известные величины и помнить, что необходимо найти.
Дано:
N(Fe) : N(O) = 7 : 10
mp-p(HNO3) = 500 г
mp-p(NaOH) = 20 г
w(NaOH) = 20%
Найти:
w(Fe(NO3)3) — ?
Уровень «Мастер»
Вы готовы сделать больше, чем записать уравнения реакции. Вы помните основные расчетные формулы и можете найти количество вещества по заданной массе и объему.
ШАГ 2. Используйте известные числовые значения, чтобы рассчитать количества вещества всех необходимых участников реакций
Переходим к действию. Нужно найти вещество, о котором мы все знаем. В приведенном примере это гидроксид натрия. Необходимо рассчитать количество вещества. Используем для этого основные расчетные формулы:
NaOH
mp-pa = 20 г
w = 0,2
m = mp-pw = 20 × 0,2 = 4 г
М = 40 г/моль
n = m : M = 4 : 40 = 0,1 моль
Задаем себе вопрос: что нам дает это значение? Каждый ответ должен вести к следующему действию. Так, мы можем рассчитать количество оксида азота IV – NO2, а благодаря ему получим количество вещества Fe3O4.
Совет: в задаче 33 по химии рассчитывайте сразу и количество вещества, и массу любого соединения, с которым работаете. Эти массы пригодятся при нахождении итогового раствора. А если не пригодятся, не переписывайте их в чистовик.
ИТОГО: +1 балл
Уровень «Гуру»
Вас не пугает уравнение с иксом в химии. Более того, вы можете его и составить, и решить.
ШАГ 3. Продумайте, как от найденных количеств вещества дойти по цепочке до искомого соединения
Что нужно найти дополнительно, чтобы получить ответ в задаче 33 по химии? Здесь может пригодиться работа с переменными, пропорции, соотношения и даже составление системы уравнений с двумя неизвестными.
Работаем!
Мы получили количества вещества нескольких соединений. Но так и не добрались до второй реакции и Fe2O3. Кроме того, мы не использовали соотношение атомов. Если вам ничего не дано для вещества по условию, а также вам не удалось подойти к нему через промежуточные расчеты, дело за уравнением. За х всегда принимайте количество неизвестного вещества.
Для нашего примера получим:
Совет: не пытайтесь принять за х все, что не получается рассчитать. Чаще всего задача 33 по химии решается без каких-либо переменных.
ИТОГО: +1 балл
Уровень «Профессионал»
Самое сложное уже позади. Теперь вам остается грамотно довести до конца. Обычно в завершении задачи требуется рассчитать массу полученного раствора и массовую долю вещества в нем. Чтобы не допустить ошибку на последнем этапе, помним, что в раствор входят все вещества, описанные в условии задачи, за исключением веществ, участвующих в реакциях сплавления, разложения и горения. Также обязательно нужно вычесть из этой массы потери. Потерями считаем осадки, газы, выпаренную воду, непрореагировавшие металлы и их оксиды.
ШАГ 4. Внимательно прочитайте вопрос задачи и рассчитайте искомую величину
Чаще всего необходимо вычислять массовую долю вещества в растворе. Предварительно вычислите массу полученного раствора с учетом всех потерь — осадков, газов и т.п.
В приведенном примере в раствор входит смесь железной окалины и оксида железа (III) и раствор азотной кислоты. Потеря — газообразное вещество NO2 (он же бурый газ).
mp-pa = m(Fe3O4) + m(Fe2O3) + mp-p(HNO3) – m(NO2) = 23,2 + 32 + 500 – 4,6 = 550,7 г
Зная количества вещества оксидов, вычислим количество вещества и массу искомой соли, а также ее массовую долю:
ИТОГО: +1 балл
Вот вы и решили 33 задачу в ЕГЭ по химии. Сложная ли она? Безусловно. Но можно ли с ней побороться? Да! Помните, что это задание, как и любое другое из второй части, оценивают согласно критериям. Не оставляйте его совсем без решения. Вы сможете остановиться на любом этапе и при этом принести в свою копилку больше, чем 0 баллов. А в пересчете на 100-балльную шкалу это будет уже весомо!
А если хотите научиться пошагово решать и другие задания из ЕГЭ по химии, записывайтесь ко мне на курсы подготовки к экзамену. Мы разберемся во всей теории, будем тренироваться в практических заданиях и научимся оформлять ответы в полном соответствии с критериями. Не теряйте возможность получить 80+ за ЕГЭ по химии — записывайтесь.
Рекомендуемые каналы
Спасибо! Поделитесь с друзьями!
Вам не понравилось видео. Спасибо за то что поделились своим мнением!
Добавлено 5 года назад от jools
Видеоразбор Демонстрационного варианта ЕГЭ 2017 по Химии.
Задание №33.
Преподаватель: Гуленков Александр.
Записаться на бесплатное пробное занятие — https://goo.gl/8kMQM4
Федеральная сеть учебных центров «Годограф», курсы подготовки к ЕГЭ и ОГЭ.
- Категория
- ЕГЭ Химия
Написать комментарий
Добавить в плейлист
К сожалению, только зарегистрированные пользователи могут создавать списки воспроизведения.
7936. При сгорании 4,6 г органического вещества образуется 8,8 г углекислого газа и 5,4 г воды. Известно, что указанное вещество газообразно при н. у., не реагирует с металлическим натрием и может быть получено дегидратацией спирта.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения исходного вещества в результате реакции дегидратации (используйте структурные формулы органических веществ).

1) Вычислим количество вещества продуктов
n(CO2) = 8,8 : 44 = 0,2 моль
n(C) = n(CO2) = 0,2 моль
m(C) = 0,2 ⋅ 12 = 2,4 г
n(H2O) = 5,4 : 18 = 0,3 моль
n(H) = 2n(H2O) = 0,3 ⋅ 2 = 0,6 моль
m(H) = 0,6 ⋅ 1 = 0,6 г
m(O) = m(в-ва) -m(C) — m(H) = 4,6 — 2,4 — 0,6 = 1,6 г
n(O) = 1,6 : 16 = 0,1 моль
Соотношение n(C) : n(H) : n(O)
x : y : z = 0,2 : 0,6 : 0,1 = 2 : 6 : 1
Простейшая формула C2H6O
2) Структурная формула
CH3-O-CH3
3) Уравнение реакции (для реакции межмолекулярной дегидратации температура должна быть менее 140 °С, например 130 °С)
2CH3-OH = (130 °С, H2SO4) CH3-O-CH3 + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7936.
7901. При сгорании 21 г органического вещества получили 33,6 л углекислого газа (н. у.) и 27 г воды. Известно, что масса 1 л (н.у.) паров этого вещества составляет 1,875 г. В результате присоединения хлороводорода к этому веществу образуется только одно монохлорпроизводное, в котором атом хлора принадлежит первичному атому углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного вещества с хлороводородом (используйте структурные формулы органических веществ).

1) Вычислим количество вещества продуктов
n(CO2) = 33,6 : 22,4 = 1,5 моль; n(C) = 1,5 моль
m(C) = 1,5 ⋅ 12 = 18 г
n(H2O) = 27/18 = 1,5 моль; n(H) = 2n(H2O) = 1,5 ⋅ 2 = 3 моль; m(H) = 3 ⋅ 1 = 3 г
m(O) = m(в-ва) — m(C) — m(H) = 21 — 18 — 3 = 0 г (кислород отсутствует)
Искомое вещество — углеводород — CxHy
Соотношение атомов n(C) : n(H) = x : y = 1,5 : 3 = 1 : 2
Простейшая формула — CH2
M(в-ва)прост. = 14 г/моль
M(в-ва)по условию = 1,875 ⋅ 22,4 = 42 г/моль
Молекулярная формула C3H6 — циклопропан или пропен. Только одно монохлорпроизводное, в котором атом хлора принадлежит к первичному атому углерода, образуется в результате присоединения хлороводорода к циклопропану (в результате реакции с пропеном получается 2-хлорпропан, атом хлора здесь принадлежит вторичному атому углероду, поэтому пропен нам не подходит)
2) Структурная формула
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7901.
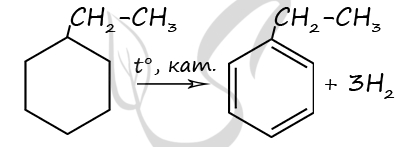
7866. Дегидрирование органического вещества приводит к образованию ароматического углеводорода, 0,7 моль которого имеют массу 74,2 г. Известно, что количество вещества водорода, выделившегося при дегидрировании исходного вещества, в 3 раза превышает количество вещества исходного углеводорода. Исходный углеводород не обесцвечивает бромную воду и раствор перманганата калия. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества; 2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции дегидрирования исходного вещества (используйте структурные формулы органических веществ).

1) Молярная масса углеводорода
M(CnH2n-6) = 74,2 / 0,7 = 106
M(CnH2n-6) = 12n + 2n — 6 = 106
14n = 112
n = 8
Молекулярная формула исходного вещества — C8H10
2) Структурная формула
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7866.
7831. Дегидрирование органического вещества приводит к образованию ароматического углеводорода, 0,3 моль которого имеют массу 27,6 г. Известно, что количество вещества водорода, выделившегося при дегидрировании исходного вещества, в 3 раза превышает количество вещества исходного углеводорода. Исходный углеводород не обесцвечивает бромную воду и раствор перманганата калия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции дегидрирования исходного вещества (используйте структурные формулы органических веществ).

1) Молярная масса углеводорода
M(CnH2n-6) = 27,6 : 0,3 = 92 г/моль
Установлена молекулярная формула ароматического углеводорода:
M(CnH2n-6) = 12n + 2n — 6 = 92
14n = 98
n = 7
Молекулярная формула — C7H8
2) Структурная формула метилциклогексана
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7831.
7796. Некоторый углеводород содержит 87,81 % углерода по массе, Известно, что молекула этого углеводорода содержит один четвертичный атом углерода. Установлено, что этот углеводород может взаимодействовать с аммиачным раствором оксида серебра с образованием осадка.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
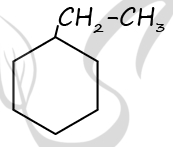
3) напишите уравнение реакции этого вещества с аммиачным раствором оксида серебра (используйте структурные формулы органических веществ).

1) Вычислим массовую долю водорода в веществе, и соотношение атомов углерода и водорода
ω(H) = 100 — 87,81 = 12,19
x : y = (87,81 / 12) : (12,19 / 1) = 0,6 : 1
Молекулярная формула — C6H10
2) Структурная формула вещества
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7796.
7761. При сжигании образца органического вещества А получено 4,48 л (н. у.) углекислого газа, 0,9 г воды и 16,2 г бромоводорода. Данное вещество А может быть получено присоединением избытка брома к соответствующему углеводороду Б. Также известно, что при бромировании этого углеводорода Б в условиях недостатка брома возможно образование структурных изомеров.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества А взаимодействием соответствующего углеводорода Б с избытком брома (используйте структурные формулы органических веществ).

1) Общая формула вещества — CxHyBrz
Вычислим количества вещества углекислого газа, воды и бромоводорода
n(CO2) = 4,48 : 22,4 = 0,2 моль; n(C) = n(CO2) = 0,2 моль
n(H2O) = 0,9 : 18 = 0,05 моль;
n(HBr) = 16,2 : 81 = 0,2 моль;
n(H) = 2n(H2O) + n(HBr) = 0,05 ⋅ 2 + 0,2 = 0,3 моль
n(Br) = n(HBr) = 0,2 моль
Соотношение: n(C) : n(H) : n(Br) = 0,2 : 0,3 : 0,2 = 2 : 3 : 2 = 4 : 6 : 4
x : y : z = 4 : 6 : 4
Молекулярная формула — C4H6Br4
2) Структурная формула вещества A:
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7761.
7726. При сжигании образца некоторого органического соединения массой 29,6 г получено 70,4 г углекислого газа и 36,0 г воды. Известно, что относительная плотность паров этого вещества по воздуху равна 2,552. В ходе исследования химических свойств этого вещества установлено, что при его взаимодействии с оксидом меди(II) образуется кетон.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции этого вещества с оксидом меди(II) (используйте структурные формулы органических веществ).

1) Общая формула вещества — CxHyOz
Вычислим количество вещества продуктов
n(CO2) = 70,4 : 44 = 1,6 моль
n(C) = n(CO2) = 1,6 моль
n(H2O) = 36,0 : 18 = 2 моль
n(H) = 2n(H2O) = 2 ⋅ 2 = 4 моль
m(H) = 4 ⋅ 1 = 4 г
m(O) = 29,6 — 1,6 ⋅ 12 — 4 = 6,4 г
n(O) = 6,4 : 16 = 0,4 моль
Определена молекулярная масса вещества
M(CxHyOz)по услов. = 2,552 ⋅ 29 = 74 г/моль
x : y : z = 1,6 : 4 : 0,4 = 4 : 10 : 1
Вычисленная формула — C4H10O
M(CxHyOz)вычисл = 74 г/моль
Молекулярная формула исх. в-ва — C4H10O
2) Структурная формула вещества
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7726.
7691. При взаимодействии соли первичного амина с ацетатом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 13,33% азота, 10,48% водорода и 30,48% кислорода по массе.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А взаимодействием соли первичного амина и ацетата серебра (используйте структурные формулы органических веществ).

1) Общая формула вещества — CxHyOzNm
Вычислим массовую долю углерода
ω(C) = 100 — 13,33 — 10,48 — 30,48 = 45,71%
x : y : z : m = 45,71/12 : 10,48/1 : 30,48/16 : 13,33/14
Соотношение атомов С, H, O и N
x : y : z : m = 3,81 : 10,48 : 1,91 : 0,95 = 4 : 11 : 2 : 1
Молекулярная формула — C4H11O2N
2) Структурная формула
CH3COO[NH3CH2CH3]
3) Уравнение реакции
CH3COOAg + Br[NH3CH2CH3] = CH3COO[NH3CH2CH3] + AgBr
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7691.
7656. Органическое вещество А содержит 11,97% азота, 9,40% водорода и 27,35% кислорода по массе и образуется при взаимодействии органического вещества Б с пропанолом-2 в молярном соотношении 1:1. Известно, что вещество Б имеет природное происхождение и способно взаимодействовать как с кислотами, так и со щелочами.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А из вещества Б и пропанола-2 (используйте структурные формулы органических веществ).

1) Общая формула — CxHyOzNm
Вычислим массовую долю углерода
ω(C) = 100 — 9,4 — 27,35 — 11,97 = 51,28%
x : y : z : m = (51,28 / 12) : (9,4 / 1) : (27,35 / 16) : (11,97 / 14)
Соотношение атомов: x : y : z : m = 5 : 11: 2 : 1
Молекулярная формула — C5H11O2N
2) Структурная функция
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7656.
7621. При сгорании 10,5 г органического вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды. Плотность паров этого вещества (н.у.) составляет 1,875 г/л. Известно, что в результате присоединения хлороводорода к этому веществу образуется только одно монохлорпроизводное.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного вещества с хлороводородом (используйте структурные формулы органических веществ).

1) Найдем количество вещества продуктов сгорания
n(CO2) = 16,8 : 22,4 = 0,75 моль
n(C) = 0,75 моль
m(C) = 0,75 ⋅ 12 = 9 г
n(H2O) = 13,5 : 18 = 0,75 моль
n(H) = 0,75 ⋅ 2 = 1,5 моль
m(H) = 1,5 ⋅ 1 = 1,5 г
m(O) = m(в-ва) — (m(C) + m(H)) = 10,5 — (9 + 1,5) = 0 г (кислород отсутствует)
Соотношение атомов углерода и водорода:
x : y = 0,75 : 1,5 = 3 : 6
Молекулярная формула — C3H6
M(C3H6) = 42 г/моль
M(в-ва)по усл. = 1,875 ⋅ 22,4 = 42 г/моль
Молекулярная формула — C3H6
Циклопропан образует лишь одно производное в реакции с хлороводородом
2) Структурная формула вещества
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7621.
Для вас приятно генерировать тесты, создавайте их почаще