Образовательный портал для подготовки к экзаменам
Химия
Сайты, меню, вход, новости
Задания
Версия для печати и копирования в MS Word
Установите соответствие между парами веществ и реагентами, с помощью которых их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПАРА ВЕЩЕСТВ
А) гексен-1 и гексан
Б) пропионовая кислота и пропанол-1
В) этилен и ацетилен
Г) крахмал и целлюлоза
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
Установим соответствие.
А) Гексен-1 и гексан. Гексен-1 будет реагировать с йодом (3), а гексан — нет.
Б) Пропионовая кислота и пропанол-1. Кислота может реагировать с гидрокарбонатом натрия (2) с выделением углекислого газа, а спирту для этого не достаточно кислотных свойств.
В) Этилен и ацетилен. Ацетилен может реагировать с аммиачным раствором оксида серебра (4).
Г) Крахмал и целлюлоза. Крахмал реагирует с йодом (3), а целлюлоза — нет.
Ответ: 3243.
Спрятать решение
·
·
Илья Манухов 02.04.2018 16:12
К варианту Б подходит два варианта: 1 и 2. Качественной реакцией на кислоту является взаимодействие с карбонатами и гидрокарбонатами (2), а качественной реакций на однотомные спирты — взаимодействие с металлическим натрием (1). Таким образом подходят оба варианта
Антон Голышев
С натрием будут реагировать оба.
Задания 30 и 31 из реального ЕГЭ по химии-2021 — ответы и решения, все задачи на окислительно-восстановительную реакцию и реакции ионного обмена из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.»
Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания.
Примечания:
1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества.
2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации.
3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту.
1. Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота.
Задание 30. Из предложенного перечня веществ выберите те, которые вступают в окислительно-восстановительную реакцию с образованием бесцветного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня веществ выберите те, между которыми реакция ионного обмена протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
1 | P-3 — 8e → P+5
8 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Фосфор в степени окисления -3 (или фосфин) является восстановителем.
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Ba2+ + 2OH— + 2H+ + 2NO3— = Ba2+ + 2NO3— + 2H2O
OH— + H+ = H2O
2. Гидрокарбонат калия, нитрат алюминия, оксид фосфора(V), азотная кислота, сульфид меди(II), гидроксид бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием окрашенного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
8 | N+5 + e → N+4
1 | S-2 — 8e → S+6
Азот в степени окисления +5 (или азотная кислота) является окислителем .
Сера в степени окисления -2 (или сульфид меди (II)) является восстановителем.
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
3. Оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием в растворе двух солей и кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена и происходит растворение белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2 | Mn+7 + 5e → Mn+2
5 | S+4 — 2e → S+6
Марганец в степени окисления +7 (или перманганат калия) является окислителем
Сера в степени окисления +4 (или оксид серы (IV)) является восстановителем
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
Mg(OH)2 + 2H+ + 2Br— = Mg2+ + 2Br— + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
4. Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием зеленого раствора и без образования осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми реакция ионного обмена протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NaMnO4 + NaNO2 + 2NaOH = 2Na2MnO4 + NaNO3 + H2O
2 | Mn+7 + 1e → Mn+6
1 | N+3 — 2e → N+5
Марганец в степени окисления +7 (или перманганат натрия) является окислителем.
Азот в степени окисления +3 (или нитрит натрия) является восстановителем.
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2
HCO3— + H+ = H2O + CO2
5. Аммиак, перманганат калия, гидросульфат лития, нитрат стронция, иод, сульфит натрия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием нерастворимого вещества и без выделения газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит натрия) является восстановителем
LiHSO4 + Sr(NO3)2 = SrSO4 + LiNO3 + HNO3
Li+ + HSO4— + Sr2+ + 2NO3— = SrSO4 + Li+ + H+ + 2NO3—
Sr2+ + HSO4— = SrSO4 + H+
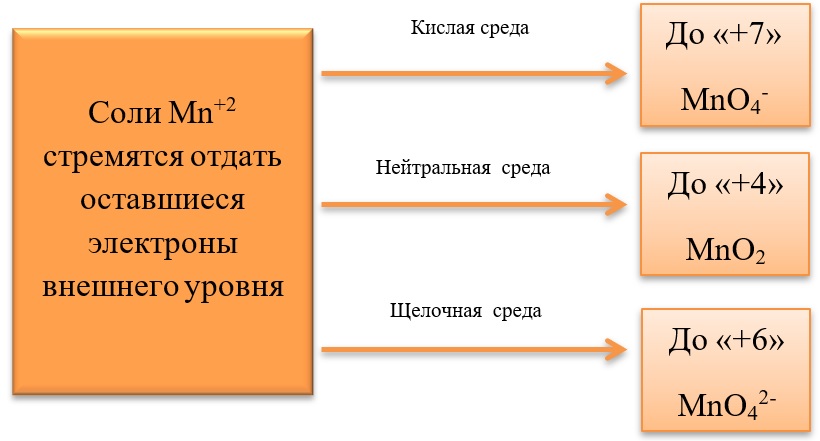
6. Гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3CaSO3 + H2O = 2MnO2 + 3CaSO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит кальция) является восстановителем
K2HPO4 + 2HCl = 2KCl + H3PO4
2K+ + HPO42- + 2H+ + 2Cl— = 2K+ + 2Cl— + H3PO4
HPO42- + 2H+ = H3PO4
7. Сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми в растворе протекает окислительно-восстановительная реакция с образованием трех солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
1 | Cr+6 + 3e → Cr+3
3 | Fe+2 — e → Fe+3
Хром в степени окисления + 6 (или дихромат калия) является окислителем
Железо в степени окисления + 2 (или сульфат железа (II)) является восстановителем
FeSO4 + (NH4)2CO3 = FeCO3 + (NH4)2SO4
Fe2+ + SO42- + 2NH4+ + CO32- = FeCO3 + 2NH4+ + SO42-
Fe2+ + CO32- = FeCO3
8. Бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота, нитрат калия, медь.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и не сопровождается выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Cu + 2KNO3 + 2H2SO4 = CuSO4 + 2NO2 + K2SO4 + 2H2O
1 | Cu0 — 2e → Cu+2
2 | N+5 + e → N+4
Азот в степени окисления + 5 (или нитрат калия) является окислителем
Медь в степени окисления 0 является восстановителем
СaBr2 + (NH4)2HPO4 = CaHPO4 + 2NH4Br
Ca2+ + 2Br— + 2NH4+ + HPO42- = CaHPO4 + 2NH4+ + 2Br—
Ca2+ + HPO42- = CaHPO4
9. Бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 16HBr = 2MnBr2 + 2KBr + 5Br2 + 8H2O
2 | Mn+7 + 5e → Mn+2
5 | 2Br— — 2e → Br20
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Бром в степени окисления -1 (или бромоводород) является восстановителем
(CH3COO)2Ba + KHSO4 = BaSO4 + CH3COOK + CH3COOH
Ba2+ + 2CH3COO— + K+ + HSO4— = BaSO4 + CH3COO— + K+ + CH3COOH
Ba2+ + CH3COO— + HSO4— = BaSO4 + CH3COOH
10. Оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием двух кислотных оксидов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
C + H2SO4 = 2CO2 + 2SO2 + H2O
1 | C0 — 4e → C+4
2 | S+6 + 2e → S+4
Сера в степени окисления + 6 (или серная кислота) является окислителем
Углерод в степени окисления 0 является восстановителем
FeCl3 + 3NaHCO3 = Fe(OH)3 + 3CO2 + 3NaCl
Fe3+ + 3Cl— + 3Na+ + 3HCO3— = Fe(OH)3 + 3CO2 + 3Na+ + 3Cl—
Fe3+ + 3HCO3— = Fe(OH)3 + 3CO2
11. Оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
1 | 2N-3 — 6e → N20
2 | Mn+7 + 3e → Mn+4
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Азот в степени окисления -3 (или аммиак) является восстановителем
3NaH2PO4 + 6KOH = 2K3PO4 + Na3PO4 + 6H2O
3Na+ + 3H2PO4— + 6K+ + 6OH— = 6K+ + 2PO43- + 3Na+ + PO43- + 6H2O
H2PO4— + 2OH— = PO43- + 2H2O
12. Оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, иод, фторид аммония.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием кислоты. При этом одна молекула восстановителя . отдает десять электронов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
I2 + 10HNO3 = 10NO2 + 2HIO3 + 4H2O
1 | I20 — 10e → 2I—
10 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем
Йод в степени окисления 0 является восстановителем
NH4F + HNO3 = NH4NO3 + HF
NH4+ + F— + H+ + NO3— = NH4+ + NO3— + HF
F— + H+ = HF
13. Оксид серы(IV), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием щелочи и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием средней соли. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 3Na2O2 = N2 + 6NaOH
1 | 2N-3 — 6e → N20
6 | O-1 + 1e → O-2
Азот в степени окисления -3 (или аммиак) является восстановителем
Кислород в степени окисления -1 (или пероксид натрия) является окислителем
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Na+ + H2PO4— + 2Na+ + 2OH— = 3Na+ + PO43- + 2H2O
H2PO4— + 2OH— = PO43- + 2H2O
14. Серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III).
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием бесцветного раствора кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием окрашенного раствора и без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
1 | P-3 — 8e → P+5
4 | S+6 + 2e → S+4
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
2Cr(OH)3 + 6H+ + 3SO42- = 2Cr3+ + 3SO42- + 6H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
15. Бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает в растворе с образованием двух кислот. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
1 | S+4 — 2e → S+6
1 | Br20 + 2e → 2Br—
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
ЕГЭ по химии 2023, 2022, 2021, 2020
Содержание раздела ЕГЭ по химии
Также смотрите разделы связанные с разделом ЕГЭ по химии:
Ниже Вы можете бесплатно скачать электронные книги и учебники и читать статьи и уроки к разделу ЕГЭ по химии 2023, 2022, 2021, 2020:
- ЕГЭ 2023, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2023, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2023, Химия, 11 класс, Кодификатор
- ЕГЭ 2023, Химия, 11 класс, Кодификатор, Проект
- ЕГЭ 2023, Химия, 11 класс, Спецификация
- ЕГЭ 2023, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2023, Химия, 11 класс, Спецификация, Кодификатор, Проект
- ЕГЭ 2023, Химия, 11 класс, Спецификация, Проект
- ЕГЭ 2023, Химия, Тематический тренинг, Доронькин В.Н., Бережная А.Г., Февралева В.А.
- ЕГЭ 2023, Химия, Типовые экзаменационные варианты, 30 вариантов, Добротин Д.Ю.
2022 год
- ЕГЭ 2022, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2022, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2022, Химия, 11 класс, Кодификатор
- ЕГЭ 2022, Химия, 11 класс, Кодификатор, Проект
- ЕГЭ 2022, Химия, 11 класс, Методические рекомендации, Добротин Д.Ю.
- ЕГЭ 2022, Химия, 11 класс, Методические рекомендации, Добротин Д.Ю., Снастина М.Г.
- ЕГЭ 2022, Химия, 11 класс, Методы познания в химии, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 11 класс, Неорганическая химия, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 11 класс, Органическая химия, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 11 класс, Открытый вариант
- ЕГЭ 2022, Химия, 11 класс, Спецификация
- ЕГЭ 2022, Химия, 11 класс, Спецификация, Кодификатор, Проект
- ЕГЭ 2022, Химия, 11 класс, Спецификация, Проект
- ЕГЭ 2022, Химия, 11 класс, Спецификация, Проект
- ЕГЭ 2022, Химия, 11 класс, Теоретические основы химии, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 11 класс, Теоретические основы химии, Химическая реакция, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2022, Химия, 11 класс, Тренировочная работа №4
- ЕГЭ 2022, Химия, 11 класс, Тренировочная работа №5
- ЕГЭ 2022, Химия, 11 класс, Тренировочные задания, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 14 вариантов, Типовые варианты, Медведев Ю.Н.
- ЕГЭ 2022, Химия, Методические материалы, Добротин Д.Ю.
- ЕГЭ 2022, Химия, Методические рекомендации, Добротин Д.Ю.
- Методические материалы для председателей и членов предметных комиссий субъектов Российской Федерации по проверке выполнения заданий с развёрнутым ответом экзаменационных работ ЕГЭ 2022 года, ХИМИЯ, Добротин Д.Ю., 2022
- Методические рекомендации обучающимся по организации индивидуальной подготовки к ЕГЭ 2022 года, Химия, Добротин Д.Ю., 2022
- Навигатор самостоятельной подготовки к ЕГЭ 2022, Химия, Методы познания в химии, Химия и жизнь, 2022
- Навигатор самостоятельной подготовки к ЕГЭ 2022, Химия, Неорганическая химия, 2022
- Навигатор самостоятельной подготовки к ЕГЭ 2022, Химия, Теоретические основы химии, Химическая реакция, 2022
- Навигатор самостоятельной подготовки к ЕГЭ 2022, Химия, Тренировочные задания, 2022
2021 год
- 100 баллов по химии, Теория и практика, Задачи и упражнения, Учебное пособие, Негребецкий В.В., 2021
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2021 года по химии
- ЕГЭ 2021, Химии, 11 класс, Демонстрационный вариант
- ЕГЭ 2021, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2021, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2021, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2021, Химия, 11 класс, Спецификация, Кодификатор, Проект
- ЕГЭ 2021, Химия, 11 класс, Тренировочный вариант
- ЕГЭ 2021, химия, 14 вариантов, типовые варианты экзаменационных заданий от разработчиков ЕГЭ, Медведев Ю.Н., 2021
- ЕГЭ 2021, Химия, Указания по оцениванию, Методические рекомендации
- ЕГЭ 2022, Химия, 11 класс, Тренировочный вариант №1, 2021
- ЕГЭ 2022, Химия, 11 класс, Тренировочный вариант №2, 2021
- ЕГЭ-2022, Химия, 10 тренировочных вариантов экзаменационных работ для подготовки к единому государственному экзамену, Савинкина Е.В., Живейнова О.Г., 2021
- Единый государственный экзамен по ХИМИИ, Открытый вариант, 2021
- Кодификатор элементов содержания и требований к уровню подготовки выпускников образовательных организаций для проведения единого государственного экзамена по химии, 2021
- Методика формирования и оценивания базовых навыков, компетенций обучающихся по программам основного общего образования по химии, необходимых для решения практико-ориентированных задач, Добротин Д.Ю., Каверина А.А., Снастина М.Г., 2021
- Методические рекомендации для учителей, подготовленные на основе анализа типичных ошибок участников ЕГЭ 2021 года по ХИМИИ, Добротин Д.Ю., Снастина М.Г., 2021
- Химия, Подготовка к ЕГЭ, Диагностические работы, Еремин В.В., 2021
2020 год
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2020 года по химии
- ЕГЭ 2020, Тренажёр, Химия, Расчётные задачи, Рябов М.А.
- ЕГЭ 2020, Химии, 11 класс, Демонстрационный вариант, Кодификатор, Спецификация, Проект
- ЕГЭ 2020, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2020, Химия, 11 класс, Кодификатор
- ЕГЭ 2020, Химия, 11 класс, Методические рекомендации, Добротин Д.Ю.
- ЕГЭ 2020, Химия, 11 класс, Спецификация
- ЕГЭ 2020, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2020, Химия, 11 класс, Спецификация, Кодификатор, Проект
- ЕГЭ 2020, Химия, 11 класс, Тренировочный вариант
- ЕГЭ 2020, Химия, 11 класс, Тренировочный вариант №1-16
- ЕГЭ 2020, Химия, Досрочный вариант
- ЕГЭ 2020, Химия, Таблица Менделеева
- ЕГЭ 2020, Химия, Таблица растворимости
- ЕГЭ 2020, Химия, Типовые варианты экзаменационных заданий от разработчиков ЕГЭ, Медведев Ю.Н., 2020
- ЕГЭ 2021, Химия, Методические рекомендации, Добротин Д.Ю., Снастина М.Г., 2020
- ЕГЭ 2021, Химия, Решение задач, Антошин А.Э., 2020
- ЕГЭ 2021, Химия, Тематические тренировочные задания, Соколова И.А., 2020
- ЕГЭ 2021, Химия, Теория и практика, Антошин А.Э., 2020
- ЕГЭ 2021, Химия, Экзаменационные варианты, Мишина В.Ю., 2020
- ЕГЭ 2022, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ, Химия, Методические рекомендации по проверке заданий с развернутым ответом, Добротин Д.Ю., 2020
- ЕГЭ, Химия, Пошаговая подготовка, Мешкова О.В., 2020
- ЕГЭ, Химия, Углублённый курс подготовки, Еремин В.В., Антипин Р.Л., Дроздов А.А., Карпова Е.В., Рыжова О.Н., 2020
- Кодификатор элементов содержания и требований к уровню подготовки выпускников образовательных организаций для проведения единого государственного экзамена по химии, 2020
- Методические рекомендации для учителей по преподаванию учебных предметов в образовательных организациях с высокой долей обучающихся с рисками учебной неуспешности, Химия, Каверина А.А., Снастина М.Г., 2020
- Спецификация контрольных измерительных материалов для проведения в 2020 году единого государственного экзамена по химии
- Тайны подготовки к ЕГЭ по химии, Лякишев В.К., 2020
2019 год
- В копилку педагогического опыта будущих учителей химии, подготовка к ОГЭ и ЕГЭ, Кожина Л.Ф., Косырева И.В., Тюрина И.В., Васильчикова О.А., 2019
- Готовимся к ЕГЭ, Органическая химия, Новошинский И.И., Новошинская Н.С., 2019
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2019 года по химии, 11 класс, 2019
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2019 года по химии, 2019
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена по ФРАНЦУЗСКОМУ ЯЗЫКУ, 2019
- ЕГЭ 2019, Химии, 11 класс, Варианты 30-35 заданий
- ЕГЭ 2019, Химия, 10 новых тренировочных вариантов, Степанов В.Н., Овчинникова О.В., Давыдова И.Б., 2019
- ЕГЭ 2019, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2019, Химия, 11 класс, Кодификатор, Проект
- ЕГЭ 2019, Химия, 11 класс, Методические рекомендации, Добротин Д.Ю., Свириденкова Н.В., Снастина М.Г.
- ЕГЭ 2019, Химия, 11 класс, Методические рекомендации, Каверина А.А., Снастина М.Г.
- ЕГЭ 2019, Химия, 11 класс, Спецификация, Кодификатор, Проект
- ЕГЭ 2019, Химия, 11 класс, Спецификация, Проект
- ЕГЭ 2019, Химия, 50 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2018
- ЕГЭ 2019, Химия, Досрочный вариант, 2019
- ЕГЭ 2019, Химия, Медведев Ю.Н., 2019
- ЕГЭ 2019, Химия, Ответы, 2019
- ЕГЭ 2019, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2019, Химия, Тренировочный вариант, 2019
- ЕГЭ 2019, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Рябов М.А.
- ЕГЭ 2019, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Рябов М.А.
- ЕГЭ 2019, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Рябов М.А.
- ЕГЭ 2020, Химия, 10 тренировочных вариантов экзаменационных работ для подготовки к единому государственному экзамену, Савинкина Е.В., Живейнова О.Г., 2019
- ЕГЭ 2020, Химия, Сборник заданий, 600 заданий с ответами, Пашкова Л.И., 2019
- ЕГЭ, Химия, 25 лучших вариантов, Яшкин С.Н., Яшкина Е.А., 2019
- ЕГЭ, Химия, Новый полный справочник, Савинкина Е.В., 2019
- ЕГЭ, Химия, Супермобильный справочник, Гога С.Т., 2019
- ЕГЭ, Химия, Универсальный справочник, Мешкова О.В., 2019
- ЕГЭ-2019, Химия, 10 тренировочных вариантов экзаменационных работ для подготовки к единому государственному экзамену, Савинкина Е.В., Живейнова О.Г., 2019
- Кодификатор элементов содержания и требований к уровню подготовки выпускников образовательных организаций для проведения единого государственного экзамена по химии, 11 класс, 2019
- Сборник заданий с досрочного ЕГЭ 2019 по химии, 2019
- Спецификация контрольных измерительных материалов для проведения в 2019 году единого государственного экзамена по ХИМИИ, 11 класс, 2019
- Формирование знаний, умений, навыков в процессе подготовки к ЕГЭ по химии, Кожина Л.Ф., Тюрина И.В., Косырева И.В., Васильчикова О.А., 2019
- Химия, ЕГЭ+, Оганесян Э.Т., Попков В.А., 2019
- Химия, ЕГЭ, Готовимся к итоговой аттестации, Каверина А.А., Медведев Ю.Н., Молчанова Г.Н., 2019
- Химия, Единый государственный экзамен, Готовимся к итоговой аттестации, Каверина А.А., Медведев Ю.Н., Молчанова Г.Н., Свириденкова Н.В., Снастина М.Г., Стаханова С.В., 2019
- Химия, Методические рекомендации по оцениванию выполнения заданий ЕГЭ с развернутым ответом, Каверина А.А., Снастина М.Г., 2019
- Химия, Подготовка к ЕГЭ в 2019 году, Диагностические работы, Еремин В.В., 2019
- Химия, Подготовка к ЕГЭ, Диагностические работы, Еремин В.В., 2019
2018 год
- ЕГЭ 2018, Химия, 10 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2017
- ЕГЭ 2018, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2018, Химия, 11 класс, Кодификатор
- ЕГЭ 2018, Химия, 11 класс, Спецификация
- ЕГЭ 2018, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2018, Химия, Вариант 113
- ЕГЭ 2018, Химия, Тренировочный вариант №16
- ЕГЭ 2018, Химия, Тренировочный вариант №17
- ЕГЭ 2018, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., 2018
- ЕГЭ 2019, Химия, 50 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2018
- ЕГЭ 2019, Химия, Решение задач, Антошин А.Э., 2018
- ЕГЭ, 1000 заданий с ответами и решениями по химии, Все задания части 1 и 2, Рябов М.А., 2018
- ЕГЭ, Химия, 10 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2018
- ЕГЭ, Химия, Алгоритмы выполнения типовых заданий, Крышилович Е.В., Мостовых В.А., 2018
- ЕГЭ, Химия, Комплекс материалов, Каверина А.А., Медведев Ю.Н., 2018
- ЕГЭ, Химия, Типовые тестовые задания, Медведев Ю.Н., 2018
- ЕГЭ-2018, Химия, Рекомендации по оцениванию заданий, Каверина А.А., Снастина М.Г., 2018
- ЕГЭ-2019, Химия, 50 тренировочных вариантов экзаменационных работ для подготовки к единому государственному экзамену, Савинкина Е.В., Живейнова О.Г., 2018
- Методические рекомендации для учителей, подготовленные на основе анализа типичных ошибок участников ЕГЭ 2018 года по химии, Добротин Д.Ю., Свириденкова Н.В.
- Химия для абитуриентов, как подготовиться к экзамену, учебное пособие, Москвичев С.М., 2018
- Химия, Большой справочник для подготовки к ЕГЭ, Доронькин В.И., Бережная А.Г., Сажнева Т.В., Февралева В.А., 2018
- Я сдам ЕГЭ, Химия, Курс самоподготовки, Технология решения заданий, Каверина А.А., Медведев Ю.Н., Молчанова Г.Н., Свириденкова Н.В., Снастина М.Г., Стаханова С.В., 2018
2017 год
- ЕГЭ 2017, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2017, Химия, 11 класс, Кодификатор элементов
- ЕГЭ 2017, Химия, 11 класс, Спецификация
- ЕГЭ 2017, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2017, Химия, Вариант 101
- ЕГЭ 2017, Химия, Методические рекомендации, Добротин Д.Ю.
- ЕГЭ 2017, Химия, Методические рекомендации, Каверина А.А., Снастина М.Г., 2016
- ЕГЭ 2017, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2018, Химия, 10 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2017
- ЕГЭ 2018, Химия, Сдаем без проблем, Антошин А.Э., 2017
- ЕГЭ, 1000 заданий с ответами и решениями по химии, Все задания части 1 и 2, Рябов М.А., 2017
- ЕГЭ, 1000 заданий с ответами и решениями по химии, Все задания части 1 и 2, Рябов М.А., 2017
- ЕГЭ, Химия, Большой сборник тематических заданий, Савинкина Е.В., 2017
- ЕГЭ, Химия, Варавва Н.Э., 2017
- ЕГЭ, Химия, Варавва Н.Э., Мешкова О.В., 2017
- ЕГЭ, Химия, Высший балл, Самостоятельная подготовка, Каверина А.А., Добротин Д.Ю., Медведев Ю.Н., 2017
- ЕГЭ, Химия, Комплекс материалов для подготовки учащихся, Каверина А.А., 2017
- ЕГЭ-2018, Химия, 50 тренировочных вариантов, Савинкина Е.В., 2017
- Химия, ЕГЭ, модульный курс, практикум и диагностика, Каверина А.А., Медведев Ю.Н., 2017
- Химия, подготовка к ЕГЭ в 2017 году, Еремин В.В., 2017
- Я сдам ЕГЭ, Химия, Модульный курс, Практикум и диагностика, Каверина А.А., Медведев Ю.Н., Молчанова Г.Н., 2017
2016 год
- ЕГЭ 2016, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2016, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2016, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2016, Химия, 11 класс, Кодификатор
- ЕГЭ 2016, Химия, 11 класс, Спецификация
- ЕГЭ 2016, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2016, Химия, Досрочный экзамен, Реальный вариант №101
- ЕГЭ 2016, Химия, Методические рекомендации по оцениванию заданий, Каверина А.А., Снастина М.Г.
- ЕГЭ 2016, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2016, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2016, Химия, Тренировочные варианты 1-15
- ЕГЭ 2016, Химия, Тренировочный вариант №1-17
- ЕГЭ 2016, Химия, Тренировочный вариант №1-19
- ЕГЭ 2016, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Лидин Р.А.
- ЕГЭ 2016, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Лидин Р.А.
- ЕГЭ 2017, Химия, 50 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2016
- ЕГЭ, Химия, 50 тренировочных вариантов экзаменационных работ, Савинкина Е.В., Живейнова О.Г., 2016
- Малый лабораторный практикум по химии для подготовки к ЕГЭ, Кожина Л.Ф., Косырева И.В., 2016
- Химия, ЕГЭ 2016, Тематический тренинг, Задания базового и повышенного уровней сложности, Доронькин В.Н., 2015
- Химия, ЕГЭ-2016, Тематический тренинг, Задания базового и повышенного уровней сложности, Доронькин В.Н., 2015
- Химия, Новые задания ЕГЭ, Доронькин В.Н., 2016
- Химия, Новый полный справочник для подготовки к ЕГЭ, Савинкина Е.В., 2016
2015 год
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2015 года по химии
- ЕГЭ 2015, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2015, Химия, Досрочный экзамен
- ЕГЭ 2015, Химия, Методические рекомендации для учителей, Каверина А.А., Снастина М.Г.
- ЕГЭ 2015, Химия, Методические рекомендации, Каверина А.А., Снастина М.Г.
- ЕГЭ 2015, Химия, Сборник заданий, Оржековский П.А., Богданова Н.Н., Васюкова Е.Ю., Мещерякова Л.М., 2014
- ЕГЭ 2015, Химия, Тематические тестовые задания, Медведев Ю.Н.
- ЕГЭ 2015, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2015, химия, типовые тестовые Задания, Медведев Ю.Н.
- ЕГЭ 2015, химия, типовые тестовые задания, Медведев Ю.Н., 2015
- ЕГЭ, Химия, Самостоятельная подготовка к ЕГЭ, Лидин Р.А., 2015
- ЕГЭ-2015, химия, самое полное издание типовых вариантов для подготовки к ЕГЭ, Савинкина Е.В., Живейнова О.Г.
- Кодификатор элементов содержания и требований к уровню подготовки выпускников образовательных организаций для проведения единого государственного экзамена по химии, 2015
- Спецификация контрольных измерительных материалов для проведения в 2015 году единого государственного экзамена по химии
- Химия, ЕГЭ 2016, Тематический тренинг, Задания базового и повышенного уровней сложности, Доронькин В.Н., 2015
- Химия, ЕГЭ-2016, Тематический тренинг, Задания базового и повышенного уровней сложности, Доронькин В.Н., 2015
- Химия, подготовка к ЕГЭ-2015, Книга 2, учебно-методическое пособие, Доронькин В.Н.
- Химия, Решение заданий повышенного и высокого уровня сложности, Как получить максимальный балл на ЕГЭ, Каверина А.А., Молчанова Г.Н., Свириденкова Н.В., Стаханова С.В., 2015
2014 год
- Демонстрационный вариант ЕГЭ 2014 по химии, 11 класс
- ЕГЭ 2014, Химия Самое полное издание типовых вариантов заданий, Каверина А.А., Добротин Д.Ю., Снастина М.Г.
- ЕГЭ 2014, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2014, Химия, 11 класс, Кодификатор
- ЕГЭ 2014, Химия, 11 класс, Спецификация
- ЕГЭ 2014, Химия, Досрочный этап, 3 варианта КИМ, с сайта ФЦТ
- ЕГЭ 2014, Химия, Методические рекомендации, Каверина А.А., Снастина М.Г.
- ЕГЭ 2014, Химия, Самое полное издание типовых вариантов заданий, Каверина А.А., Добротин Д.Ю., Снастина М.Г., 2014
- ЕГЭ 2014, Химия, Типовые тестовые задания, Медведев
- ЕГЭ 2014, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2014, Химия, Тренировочная работа с ответами, Варианты 501-502, 30.01.2014
- ЕГЭ 2014, Химия, Тренировочная работа №1 с ответами, Варианты 101-104, 25.10.2013
- ЕГЭ 2015, Химия, Сборник заданий, Оржековский П.А., Богданова Н.Н., Васюкова Е.Ю., Мещерякова Л.М., 2014
- ЕГЭ, Химия, 11 класс, Тренировочная работа, Варианты 10701-10702, 2014
- Кодификатор ЕГЭ 2014 по химии, 11 класс
- Спецификация ЕГЭ 2014 по химии, 11 класс
- Химия, Подготовка к ЕГЭ 2014, Диагностические работы, Богданова Н.Н., Смирнов С.С.
- Химия, подготовка к ЕГЭ-2015, Книга 1, учебно-методическое пособие, Доронькин В.Н., 2014
- Химия, Полный курс подготовки к ЕГЭ + мультимедийный репетитор Яндекс, Асанова Л.И., Вережникова О.Н., 2014
2013 год
- Демонстрационный вариант ЕГЭ 2013 по химии, 11 класс
- Диагностическая работа №1 по химии, ЕГЭ 2013, 11 класс, 2012
- ЕГЭ 2013 по химии, 11 класс, Диагностическая работа №2, Краткая
- ЕГЭ 2013 по химии, 11 класс, Диагностическая работа №2.
- ЕГЭ 2013 по химии, 11 класс, Тренировочная работа №4
- ЕГЭ 2013, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2013, Химия, 11 класс, Диагностическая работа №1, 2012
- ЕГЭ 2013, Химия, 11 класс, Диагностическая работа №2
- ЕГЭ 2013, Химия, 11 класс, Кодификатор
- ЕГЭ 2013, Химия, 11 класс, Спецификация
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №1, Вариант 1-4, 2012
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №2
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №3, В формате ЕГЭ
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №3, На один урок
- ЕГЭ 2013, Химия, Методические рекомендации, Каверина А.А., Снастина М.Г.
- ЕГЭ 2013, Химия, Основной этап, Дальний Восток
- ЕГЭ 2013, Химия, Основной этап, Сибирь
- ЕГЭ 2013, Химия, Основной этап, Урал
- ЕГЭ 2013, Химия, Основной этап, Центр
- ЕГЭ 2013, Химия, Решение задач, Сдаем без проблем, Антошин А.Э., 2012
- ЕГЭ 2013, Химия, Самое полное издание типовых вариантов заданий, Каверина А.А., Добротин Д.Ю., Снастина М.Г.
- ЕГЭ 2013, Химия, Самое полное издание типовых вариантов, Каверина А.А., Добротин Д.Ю., Снастина М.Г.
- ЕГЭ 2013, Химия, Тематические тренировочные задания, Соколова И.А., 2012
- ЕГЭ 2013, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А., 2012
- ЕГЭ 2013, Химия, Тренировочные задания, Оржековский П.А., Мишина В.Ю., 2012
- ЕГЭ 2013, Химия, Тренировочные задания, Оржековский П.А., Мишина В.Ю., Пашкова Л.И., 2012
- ЕГЭ 2013, Химия, Шпаргалки
- ЕГЭ 2014, Химия, Тренировочная работа №1 с ответами, Варианты 101-104, 25.10.2013
- ЕГЭ, Химия, 11 класс, Диагностическая работа, Варианты 10601-10604, 21.05.2013
- ЕГЭ, Химия, 11 класс, Тематическая диагностическая работа, Варианты 00203-00204, 2013
- ЕГЭ, Химия, Полный курс A,B,C, Самостоятельная подготовка к ЕГЭ, Лидин Р.А., 2013
- ЕГЭ, Химия, Самостоятельная подготовка к ЕГЭ, Лидин Р.А., 2013
- ЕГЭ, Химия, Самостоятельная подготовка, Полный курс A,B,C, Лидин Р.А., 2013
- ЕГЭ-2013, Химия, Типовые тестовые задания, Медведев Ю.Н.
- Кодификатор ЕГЭ 2013 по химии, 11 класс
- Спецификация ЕГЭ 2013 по химии, 11 класс
2012 год
- Диагностическая работа №1 по химии, ЕГЭ 2013, 11 класс, 2012
- ЕГЭ 2012, 11 класс, Химия, Демонстрационный вариант, 2011
- ЕГЭ 2012, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2012, Химия, 11 класс, Диагностическая работа №1, 2011
- ЕГЭ 2012, Химия, 11 класс, Диагностическая работа №2
- ЕГЭ 2012, Химия, 11 класс, Диагностическая работа, 2011
- ЕГЭ 2012, Химия, 11 класс, Кодификатор
- ЕГЭ 2012, Химия, 11 класс, Спецификация
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №1, 2011
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №2
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №4
- ЕГЭ 2012, Химия, Актив-тренинг, Каверина А.А., 2011
- ЕГЭ 2012, Химия, Анализ
- ЕГЭ 2012, Химия, Демонстрационный вариант
- ЕГЭ 2012, Химия, Оптимальный банк заданий для подготовки учащихся, Каверина А.А.
- ЕГЭ 2012, Химия, Оптимальный банк заданий, Каверина А.А.
- ЕГЭ 2012, Химия, Практикум, Медведев Ю.Н.
- ЕГЭ 2012, Химия, Решение задач, Сдаем без проблем, Антошин А.Э., 2011
- ЕГЭ 2012, Химия, Сдаем без проблем, Антошин А.Э., 2011
- ЕГЭ 2012, Химия, Сдаем без проблем, Антошин, 2011
- ЕГЭ 2012, Химия, Типовые тестовые задания, Медведев Ю.Н., 2012
- ЕГЭ 2012, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина
- ЕГЭ 2012, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А.
- ЕГЭ 2012, Химия, Тренировочная работа №2, 11 класс
- ЕГЭ 2012. Химия. 11 класс. Демонстрационный вариант. 2011
- ЕГЭ 2012. Химия. 11 класс. Кодификатор. 2011
- ЕГЭ 2012. Химия. 11 класс. Спецификация. 2011
- ЕГЭ 2012. Химия. Актив-тренинг. Каверина А.А. 2011
- ЕГЭ 2012. Химия. Демонстрационный вариант.
- ЕГЭ 2012. Химия. Самое полное издание типовых вариантов. Каверина А.А., Добротин Д.Ю. 2011
- ЕГЭ 2012. Химия. Типовые тестовые задания. Медведев Ю.Н. 2011
- ЕГЭ 2013, Химия, 11 класс, Диагностическая работа №1, 2012
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №1, Вариант 1-4, 2012
- ЕГЭ 2013, Химия, Решение задач, Сдаем без проблем, Антошин А.Э., 2012
- ЕГЭ 2013, Химия, Тематические тренировочные задания, Соколова И.А., 2012
- ЕГЭ 2013, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А., 2012
- ЕГЭ 2013, Химия, Тренировочные задания, Оржековский П.А., Мишина В.Ю., 2012
- ЕГЭ 2013, Химия, Тренировочные задания, Оржековский П.А., Мишина В.Ю., Пашкова Л.И., 2012
- ЕГЭ 2013, Химия, Тренировочные задания, Оржековский П.А., Мишина В.Ю., Пашкова Л.И., 2012
- ЕГЭ по химии, Тематические тесты, Новые задания, Химический эксперимент (С2), Доронькин В.Н., Бережная А. Г., Сажнева Т.В., Февралева В.А., 2012
- ЕГЭ, Химия, 11 класс, 68 диагностических варианта, Савинкина Е.В., 2012
- ЕГЭ, Химия, 11 класс, 68 диагностических вариантов, Савинкина Е.В., 2012
- ЕГЭ, Химия, 11 класс, 68 диагностических вариантов, Савинкина Е.В., 2012
- ЕГЭ, Химия, Зачеты и эталоны, Часть 3, 2012
- ЕГЭ, Химия, Методические рекомендации, Часть 1, 2012
- ЕГЭ, Химия, Самостоятельные работы, Часть 2, 2012
- ЕГЭ, Химия, Экспресс-подготовка, Мешкова О.В., 2012
- ЕГЭ, Шпаргалка по химии, Копылова Н.А., 2012
- ЕГЭ-2013, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А., 2012
- Кодификатор ЕГЭ 2012 по химии, 11 класс
- Подготовка к ЕГЭ по химии, Доронькин В.Н., 2012
- Самое полное издание типовых вариантов заданий ЕГЭ 2012, Химия, Каверина А.А., Добротин Д.Ю., 2012
- Спецификация ЕГЭ 2012 по химии, 11 класс
- Химия, 10 класс, Краевая диагностическая работа, УМК 1, 2012
- Химия, 10 класс, Краевая диагностическая работа, УМК 2, 2012
- Химия, 11 класс, Краевая диагностическая работа, 2012
- Химия, Диагностические работы в формате ЕГЭ, Еремин В.В., Дроздов А.А., 2012
- Химия, Подготовка к ЕГЭ 2012, Доронькин В.Н., 2012
- Химия, Тематические тесты для подготовки к ЕГЭ, Задания высокого уровня сложности (С1-С5), Доронькин В.Н., 2012
- Химия, Тематические тесты для подготовки к ЕГЭ, Задания высокого уровня сложности (С1-С5), Доронькин В.Н., Бережная А.Г., 2012
- Химия, Тематические тесты для подготовки к ЕГЭ, Задания высокого уровня сложности Cl-C5, Доронькин В.Н., 2012
2011 год
- ЕГЭ 2011, Химия, 11 класс, Диагностическая работа №1, 2010
- ЕГЭ 2011, Химия, 11 класс, Диагностическая работа №2
- ЕГЭ 2011, Химия, 11 класс, Пробный вариант, 2010
- ЕГЭ 2011, Химия, 11 класс, Реальные фото с экзамена
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №1, 2010
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №2, 2010
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №4
- ЕГЭ 2011, Химия, Методические рекомендации
- ЕГЭ 2011, Химия, Самое полное издание типовых вариантов заданий, Корощенко А.С., Каверина А.А., Добротин Д.Ю.
- ЕГЭ 2011, Химия, Универсальные материалы, Каверина А.А., Корощенко А.С., Медведев Ю.Н.
- ЕГЭ 2011. Химия. 10-11 класс. Тематические тестовые задания. Корощенко А.С., Яшукова А.В. 2011
- ЕГЭ 2011. Химия. 11 класс. Демонстрационный вариант. 2011
- ЕГЭ 2011. Химия. 8-9 класс. Тематические тестовые задания. Корощенко А.С., Яшукова А.В. 2011
- ЕГЭ 2011. Химия. Анализ. 2011
- ЕГЭ 2011. Химия. Демонстрационный вариант. Спецификация.
- ЕГЭ 2011. Химия. Самое полное издание типовых вариантов заданий. Каверина А.А., Корощенко А.С., Добротин Д.Ю. 2011
- ЕГЭ 2011. Химия. Типовые тестовые задания. Медведев Ю.Н. 2011
- ЕГЭ 2011. Химия. Универсальные материалы. Каверина А.А., Корощенко А.С., Медведев Ю.Н. 2011
- ЕГЭ 2012, 11 класс, Химия, Демонстрационный вариант, 2011
- ЕГЭ 2012, Химия, 11 класс, Диагностическая работа №1, 2011
- ЕГЭ 2012, Химия, 11 класс, Диагностическая работа, 2011
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №1, 2011
- ЕГЭ 2012, Химия, Актив-тренинг, Каверина А.А., 2011
- ЕГЭ 2012, Химия, Решение задач, Сдаем без проблем, Антошин А.Э., 2011
- ЕГЭ 2012, Химия, Сдаем без проблем, Антошин А.Э., 2011
- ЕГЭ 2012, Химия, Сдаем без проблем, Антошин, 2011
- ЕГЭ 2012. Химия. 11 класс. Демонстрационный вариант. 2011
- ЕГЭ 2012. Химия. 11 класс. Кодификатор. 2011
- ЕГЭ 2012. Химия. 11 класс. Спецификация. 2011
- ЕГЭ 2012. Химия. Актив-тренинг. Каверина А.А. 2011
- ЕГЭ 2012. Химия. Самое полное издание типовых вариантов. Каверина А.А., Добротин Д.Ю. 2011
- ЕГЭ 2012. Химия. Типовые тестовые задания. Медведев Ю.Н. 2011
- ЕГЭ по химии, Экспресс-репетитор для подготовки к ЕГЭ, Егоров А.С., Аминова Г.Х., 2011
- ЕГЭ по химии, Экспресс-репетитор, Егоров А.С., Аминова Г.Х., 2011
- ЕГЭ, Репетитор по химии, Белов Н.В., 2011
- ЕГЭ, Репетитор по химии, Белов, 2011
- ЕГЭ, Химия, 10 класс, 52 диагностических варианта, Савинкина Е.В., 2011
- ЕГЭ, Химия, 10-11 класс, Тематические тестовые задания, Корощенко А.С., Яшукова А.В., 2011
- ЕГЭ, Химия, 8-9 класс, Тематические тестовые задания, Корощенко А.С., Яшукова А.В., 2011
- Комплекс заданий по химии для подготовки к ЕГЭ, Аввакумова Н.П., Фомин И.В., 2011
- Химия, 10 класс, Краевая диагностическая работа, УМК 1-2, 2011
- Химия, Экспресс-репетитор для подготовки к ЕГЭ, Егоров А.С., Аминова Г.Х., 2011
- Химия, Экспресс-репетитор для подготовки к ЕГЭ, Егоров А.С., Аминова Г.Х., 2011
- Химия. Тематические тесты для подготвки к ЕГЭ. Доронькин В.Н. 2011
2010 год
- ЕГЭ — Химия — Практикум по выполнению типовых тестовых заданий ЕГЭ — Медведев Ю.Н.
- ЕГЭ 2010 — Химия — Типовые тестовые задания — Медведев Ю.Н.
- ЕГЭ 2010, Химия, 11 класс, Вариант №1
- ЕГЭ 2010, Химия, 11 класс, Вариант №121
- ЕГЭ 2010, Химия, 11 класс, Вариант №128
- ЕГЭ 2010, Химия, 11 класс, Вариант №133
- ЕГЭ 2010, Химия, 11 класс, Вариант №2
- ЕГЭ 2010, Химия, 11 класс, Вариант №3
- ЕГЭ 2010, Химия, 11 класс, Вариант №4
- ЕГЭ 2010, Химия, 11 класс, Вариант №5
- ЕГЭ 2010, Химия, 11 класс, Варианты №101, 103-108
- ЕГЭ 2010, Химия, 11 класс, Диагностическая работа
- ЕГЭ 2010, Химия, 11 класс, Диагностическая работа, 2009
- ЕГЭ 2010, Химия, 11 класс, Реальный вариант
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №1, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №2, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №4, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №5
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №6
- ЕГЭ 2010, Химия, Пробный вариант ЕГЭ №1
- ЕГЭ 2010, Химия, Пробный вариант ЕГЭ №2
- ЕГЭ 2010, Химия, Пробный вариант ЕГЭ №3
- ЕГЭ 2010. Химия. Анализ. 2010
- ЕГЭ 2010. Химия. Демонстрационный вариант.
- ЕГЭ 2010. Химия. Кодификатор.
- ЕГЭ 2011, Химия, 11 класс, Диагностическая работа №1, 2010
- ЕГЭ 2011, Химия, 11 класс, Пробный вариант, 2010
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №1, 2010
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №2, 2010
- ЕГЭ по химии — Демонстрационный вариант — 2010
- ЕГЭ-2010 — Химия — самые новые реальные задания — Корощенко А.С., Снастина М.Г.
- ЕГЭ. Химия. Универсальный справочник. Мешкова О.В. 2010
- Отличник ЕГЭ — Химия — Решение сложных задач — Каверина А.А., Корощенко А.С., Добротин Д.Ю., Медведев Ю.Н., Снастина М.Г.
- Отличник ЕГЭ — Химия — Решение сложных задач — Каверина А.А., Корощенко А.С., Добротин Д.Ю., Медведев Ю.Н., Снастина М.Г. — 2010
- Самое полное издание типовых вариантов реальных заданий ЕГЭ 2010 — Химия — Корощенко А.С., Снастина М.Г.
- Химия — Подготовка к ЕГЭ — Тематические тесты — Базовый и повышенный уровни — 10-11 класс — Доронькин В.Н., Бережная А.Г., Сажнева Т.В., Февралёва В.А.
- Химия, 11 класс, Краевая диагностическая работа, 10.2010
- Химия, 11 класс, Краевая диагностическая работа, 2010
- Химия. Подготовка к ЕГЭ 2010. Доронькин В.Н. 2009
2009 год
- ЕГЭ 2009 — Химия — Репетитор — Оржековский П.А., Богданова В.В.
- ЕГЭ 2009 — Химия — Сборник заданий — Оржековский П.А., Богданова В.В., Васюкова Е.Ю., Мещерякова Л.М.
- ЕГЭ 2009 — Химия — Сборник экзаменационных заданий — Каверина А.А., Медведев Ю.Н., Добротин Д.Ю.
- ЕГЭ 2009 по химии, 11 класс, 37 вариантов
- ЕГЭ 2009 по химии, Репетиционный экзамен
- ЕГЭ 2009, Химия, 11 класс, Репетиционный экзамен
- ЕГЭ 2009, Химия, 11 класс, Тренировочная работа №1
- ЕГЭ 2009, Химия, 11 класс, Тренировочная работа №2
- ЕГЭ 2009, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2009, Химия, Методическое письмо
- ЕГЭ 2009. Химия. Анализ. 2009
- ЕГЭ 2010, Химия, 11 класс, Диагностическая работа, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №1, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №2, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №4, 2009
- ЕГЭ по химии — Демонстрационный вариант — 2009
- ЕГЭ, Химия, 11 класс, Демонстрационный вариант, 2009
- ЕГЭ-2009 — Химия — Самые новые реальные задания — Корощенко А.С., Снастина М.Г.
- Единый государственный экзамен, химия, задания для абитуриентов, Лукин П.М., 2009
- Подготовка к ЕГЭ на 100 баллов. Химия. 2009
- Самое полное издание типовых вариантов реальных заданий — ЕГЭ 2009 — Химия — Корощенко А.С., Снастина М.Г.
- Химия. Подготовка к ЕГЭ 2010. Доронькин В.Н. 2009
- Химия. Полный справочник для подготовки к ЕГЭ. Лидин Р.А. 2009
2008 год
- ЕГЭ 2008 по химии, 35 вариантов с ответами
- ЕГЭ 2008, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2008, Химия, Анализ
- ЕГЭ 2008, Химия, Экзамен, 20 вариантов
- ЕГЭ 2008, Химия, Экзамен, Вариант №10
- ЕГЭ 2008. Химия. Самое полное издание реальных заданий. Корощенко А.С., Снастина М.Г. 2008
- ЕГЭ по химии — 2008.
- ЕГЭ по химии — Демонстрационный вариант — 2008.
- Самое полное издание реальных заданий ЕГЭ. Химия — Корощенко А.С., Снастина М.Г. — 2008
2007 год
- Аналитический отчет о результатах ЕГЭ по химии 2007 года
- ЕГЭ по химии — 2007.
- ЕГЭ, Химия, 11 класс, Контрольные и проверочные работы, Габриелян О.С., 2007
- Методическое письмо «Об использовании результатов единого государственного экзамена 2007 года в преподавании химии в средней школе» — 2007
- Экзаменационные материалы для подготовки к единому государственному экзамену — ЕГЭ 2007 — Химия — Стрельникова Е.Н.
2006 год
- ЕГЭ 2006, Химия, 11 класс, 29 реальных вариантов
- ЕГЭ по химии — Демонстрационный вариант — 2006
2005 год
- ЕГЭ по химии — Демонстрационный вариант — 2005.
2004 год
- ЕГЭ по химии — демонстрационный вариант — 2004
2003 год
- ЕГЭ 2003, Химия, 11 класс, Экзамен, Вариант №1201
- ЕГЭ, Шпаргалка по химии
2002 год
- ЕГЭ — Химия — Варианты контрольных измерительных материалов — 2002
- ЕГЭ 2002, Химия, 11 класс, Экзамен, Вариант №151
- ЕГЭ по химии — Демонстрационный вариант — 2002.
ЕГЭ по химии разных годов
- ЕГЭ по химии, Таблицы
- ЕГЭ по химии, Таблицы по химии
- Результаты ЕГЭ по химии
- Химия, Полный справочник для подготовки к ЕГЭ, Лидин Р.А.
Содержание раздела ЕГЭ по химии
Описание раздела «ЕГЭ по химии 2023»
Здесь Вы можете скачать реальные задания ЕГЭ по химии 2023, 2022, 2021, 2020, 2019, 2018, 2017, 2016, 2015, 2014 и 2013, демоверсии ЕГЭ по химии, демонстрационную версию ЕГЭ, реальные и демонстрационные варианты по предмету химия, реальные официальные варианты.
Единый Государственный Экзамен по химии не является обязательным для сдачи при выпускных экзаменах в школе, но его придется сдавать тем, кто хочет поступить в Медицинский, Химико-технологический, Строительный, Биотехнологический ВУЗ.
Вы можете смотреть результаты ЕГЭ по химии здесь: http://check.ege.edu.ru/.
График загрузки результатов ЕГЭ (график обработки экзаменационных работ): http://www.ege.edu.ru/ru/classes-11/res/ .
По статистике один из десяти выпускников выбирает для сдачи предмет химию. И специально для данных 10% мы предоставляем вам демонстрационные варианты ЕГЭ по химии 2023, 2022, 2021, 2020, 2019, 2018, 2017, 2016, 2015, 2014, 2013, 2012, 2011, 2010, 2009.
А также самое полное издание типовых вариантов реальных заданий, сборник экзаменационных и самых новых реальных заданий, тематические тесты — базовый и повышенный уровни, практикум по выполнению типовых тестовых заданий ЕГЭ, аналитический отчет о результатах ЕГЭ по химии прошлого года.
Здесь вы найдете материалы следующих авторов ЕГЭ по химии: Корощенко А.С., Снастина М.Г., Каверина А.А., Медведев Ю.Н., Добротин Д.Ю., Оржековский П.А., Богданова В.В., Васюкова Е.Ю., Мещерякова Л.М., Оржековский П.А., Корощенко А.С., Доронькин В.Н., Бережная А.Г., Сажнева Т.В., Февралёва В.А.
Результаты ЕГЭ по химии.
Информацию о результатах ЕГЭ смотрите здесь.
Группы заданий ЕГЭ по химии.
В 2012 и 2013 году тест ЕГЭ по химии содержал 43 вопроса.
В 2014 году тест ЕГЭ по химии содержит 43 вопроса, сгруппированных по типам заданий и разбитых на три части по уровню сложности:
- Задания А1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21, A22, A23, A24, A25, A26, A27, A28 – это вопросы базовой сложности, при ответе нужно выбрать 1 правильный ответ из 4-х, за каждое правильно выполненное задание Вы получите один первичный балл.
- Задания В1, B2, B3, B4, B5, B6, B7, B8, B9, B10 – вопросы средней сложности, ответы на эти вопросы необходимо дать кратко, в виде числа или последовательности цифр.
- Задания С1, C2, C3, C4, C5 — задания очень высокой сложности, на них необходимо дать подробный ответ на вопрос по неорганической и органической химии.
На экзамене можно использовать периодическую систему химических элементов Менделеева Д.И., таблицу растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов, а также непрограммируемый калькулятор, который выдается на экзамене.
Используя материалы для подготовки к тестам, Вы успешно сдадите экзамен ЕГЭ по химии в 2023 году.
В результате выполнения задания 4 ЕГЭ по химии проверяются следующие требования/умения:
Коды проверяемых требований к уровню подготовки (по кодификатору):
Читать подробнее…
Коды проверяемых элементов содержания (по кодификатору):
Уровень сложности задания:
Максимальный балл за выполнение задания:
Примерное время выполнения задания выпускником, изучавшим предмет:
Межмолекулярные водородные связи в жидком состоянии характерны для:
1. водорода
2. воды
3. аммиака
4. ацетальдегида
5. изобутана
И ионные, и ковалентные химические связи имеются в веществе:
1. НСl
2. H2SO4
3. NaOH
4. NH4Br
5. С2Н5ОН
Ионные связи реализуются в каждом из двух веществ:
1. Аl2O3 и FeCl3
2. K2S и NaNO3
3. KNO2 и NO2
4. HF и НСl
5. NaBr и NH4F
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
1) N2
2) НСlO
3) NH4Br
4) НСl
5) Р4
Ковалентные неполярные химические связи имеются в веществах:
1. белый фосфор
2. ортофосфорная кислота
3. аммиак
4. этиловый спирт
5. сера ромбическая
Немолекулярное строение имеют:
1. гидроксид калия
2. аммиак
3. уксусная кислота
4. азотная кислота
5. графит
Из предложенного перечня выберите два соединения, в которых присутствует и ионная, и ковалентная химическая связь.
1. Ca(NO3)2
2. НСlO
3. NH4Br
4. НВг
5. H2SO4
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная химическая связь.
1. H2
2. NH3
3. CaO
4. BaF2
5. NaBr
Из предложенного перечня выберите два соединения, между молекулами которых образуется водородная химическая связь.
1. H2
2. C2H5OH
3. C2H6
4. CH2=CH2
5. H2O
В сульфате калия присутствуют химические связи:
1. ионные
2. ковалентные неполярные
3. ковалентные полярные
4. водородные
5. металлические
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
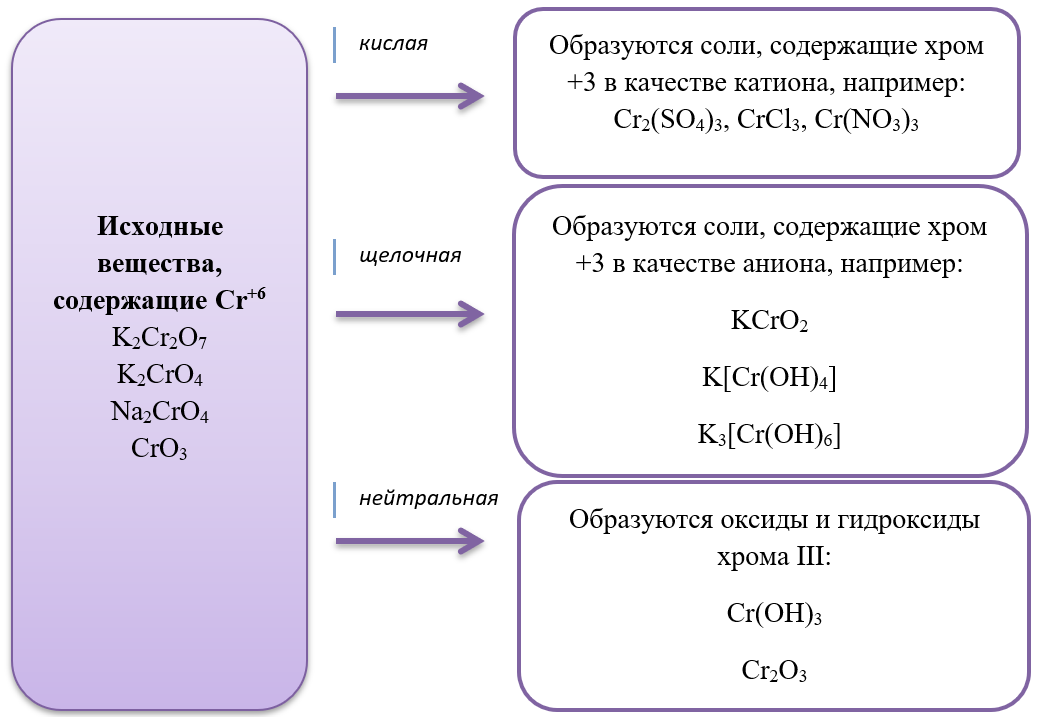
- 15) Хром и его соединения
- 16) Железо и его соединения
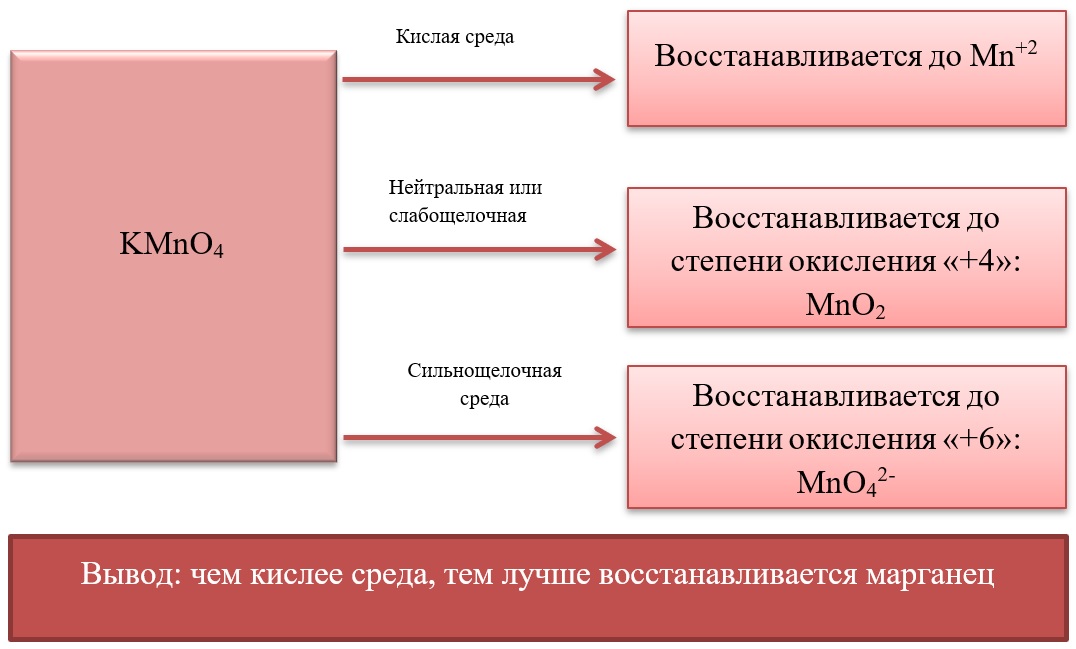
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
 Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
17) Соединения марганца
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl
- 29.03.2022
Начинаем собирать реальные варианты ЕГЭ 2022 года по химии. Все варианты собираются и публикуются после проведения экзамена.
- Смотреть реальные варианты ЕГЭ 2022 по всем предметам
ОБНОВЛЕНОЕ 27.05.2022
Варианты с досрочного ЕГЭ 2022 по химии, с реальной основной волны от 26 мая 2022. Смотрим, разбираем. Все варианты будут сопровождаться видеоуроками, на которых будут разобраны примеры решения, правильные ответы и т.д.
- Другие варианты ЕГЭ по химии (включая Статград)
Есть вопросы? Пишите их ниже! Обсудим, решим, ответим.
- Вариант досрочного ЕГЭ 2022 по химии от 21.03.2022 — 5 вариантов разборов
- Открытый вариант от ФИПИ ЕГЭ 2022 по химии (аналог досрочного варианта) от 28.04.2022
Вариант №1 от 26 мая 2022
Вариант №2 от 26 мая 2022
Вариант №3 с Дальнего востока
Вариант №4 с Дальнего востока
Как прошла основная волна ЕГЭ 2022 по химии
Некоторые задания с основной волны от 26.05.2022
Задание 1:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) CuSO4
Б) KOH
В) Na2CO3
Г) Al(OH)3
Реагенты:
1) KOH, Ba(NO3)2, H2S
2) SiO2, Al, H2S
3) HNO3, NaOH, H2SO4
4) H2SiO3, Al, BaSO4
5) HNO3, BaCl2, MgCl2
Решение:
Сульфат меди(II) – это средняя соль, растворимая в воде, которая реагирует
— с щелочами(с образованием нерастворимого основания Cu(OH)2),
— солями(нитратом бария, в результате взаимодействия с которыми образуется осадок),
— кислотами(сероводородом — образуется сульфид меди(II) осадок бурого цвета);
Ответ 1.
Гидроксид калия – это растворимое основание, щелочь, которая вступает в реакции нейтрализации с кислотами и кислотными оксидами, амфотерными металлами; ответ 2.
Карбонат натрия – это средняя соль, как и все соли натрия, растворимая в воде, подобно другим солям реагирует со сложными веществами(щелочами, кислотами, другими солями) с образованием осадков, газов, воды, здесь подходит вариант ответа 5, так как в результате реакций с хлоридом бария и магния образуется два осадка в виде BaCO3 и MgCO3.
Гидроксид алюминия – амфотерное нерастворимое основание, которое реагирует
— с щелочами,
— с кислотами,
Ответ 3.
Задание 2:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) C
Б) S
В) CO2
Г) FeO
Реагенты:
1) P, Cu(OH)2, HNO3
2) H2O, KOH, CaO
3) CO, LiOH, N2
4) S, Ba, O2
5) HNO3, O2, C
Решение:
Углерод – неметалл, образующий целый раздел органической химии, благодаря которому образовались белки, жиры, углеводы, реагирует
— с неметаллами(например, серой, кислородом),
— металлами(например, барием, алюминием с образованием карбидов).
Ответ 4.
Сера – неметалл желтого цвета, реагирует с большим количеством веществ, в том числе, с кислородом, водородом, углеродом, азотной кислотой.
S + 6HNO3(к.) = H2SO4 + 6NO2 + 2H2O
S + 2HNO3(р.) = H2SO4 + 2NO
Важно! Заметьте, что в реакциях серы с разбавленной HNO3 выделяется оксид азота NO2, а с концентрированной азотной кислотой выделяется оксид азота NO.
Этот же принцип соблюдается в реакциях разбавленной и концентрированной кислот с металлами и другими неметаллами.
Ответ 5.
Углекислый газ – составляющая часть воздуха и выделяемого нашим организмом газа в результате энергетического обмена, этот газ является солеобразующим кислотным оксидом, который взаимодействует
— с основными оксидами,
— основаниями,
— водой.
Ответ 2.
FeO – основный оксид железа(II) черного цвета, не токсичен, не растворим в воде, реагирует
— с кислотами,
— с щелочами(сплавление),
— с углеродом(восстановление, t > 1000 C):
FeO + C = Fe + CO
— с кислородом(происходит окисление железа, t >400 C):
6FeO + O2 = 2Fe3O4
Ответ 5.
Задание 3:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Al(OH)3
Б) P2O3
В) MgBr2
Г) P
Реагенты:
1) HBr, KOH, Ba(OH)2
2) KOH, Na3PO4, Cl2
3) HNO3, HCl, Cl2
4) O2, KOH, HNO3
5) S, HCl, O2
Решение:
Al(OH)3 – амфотерное нерастворимое основание, реагирует
— с щелочами,
— с кислотами.
Ответ 1.
P2O3 – оксид фосфора(III), в виде белых хлопьев, высокотоксичное соединение, реагирует
— с водой,
— с галогенами,
— с щелочами,
— с неметаллами(сера, кислород)
Ответ 4.
MgBr2 – бромид магния, средняя соль, растворимая в воде, взаимодействует
— с кислотами,
— с щелочами,
— с солями(при наличии осадка),
— с галогенами(стоящими выше в ПСЭ, чем бром),
Ответ 2.
Фосфор – это типичный неметалл, имеет три аллотропические модификации в виде белого(ядовитого), красного и черного фосфора, вступает в реакции со многими веществами, в частности, реагирует
— с неметаллами(кислородом, водородом, серой, галогенами),
— с металлами(образует фосфиды),
— с водой(водяным паром при t > 500 C),
— с щелочами,
— с сильными кислотами(например, с азотной):
P(красн.) + 5HNO3(к.) = H3PO4 + 5NO2 + H2O
3P + 5HNO3(р.) + 2H2O = H3PO4 + 5NO
Ответ 4.
Задание 4:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Na2S
Б) Zn(OH)2
В) P2O5
Г) S
Реагенты:
1) O2, Fe, Br2
2) Cl2, FeSO4, HI
3) Li2O, Sr(OH)2, H2O
4) NH3, Ca3(PO4)3, HNO3
5) KOH, H3PO4, HCl
Решение:
Сульфид натрия – это растворимая средняя соль, которая реагирует
— с водой,
— с кислотами,
— с солями,
— с галогенами.
Ответ 2
Гидроксид цинка – это амфотерное нерастворимое основание, проявляет все свойства амфотерного гидроксида, реагируя
— с кислотами,
— с щелочами.
Ответ 5
Оксид фосфора(V) – это солеобразующий кислотный оксид, который вступает в реакцию
— с основаниями,
— с основными оксидами,
— с солями,
— с водой(образуя ортофосфорную кислоту).
Ответ 3
Сера – неметалл желтого цвета, реагирует с большим количеством веществ, в том числе, — с кислородом(образуя оксиды),
— с водородом(H2S),
— с углеродом(CS2),
— с галогенами(SCl2 – при расплаве, SF6 – при комнатной t),
— металлами.
Ответ 1
Задание 5:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) NH4Br
Б) HNO3
В) Ba(OH)2
Г) Na
Реагенты:
1) HCl, CO2, K3PO4
2) AgNO3, NaOH, Ca(OH)2
3) Pb, S, C
4) CaO, Br2, Na2SO4
5) S, Cl2, H2O
Решение:
Бромид аммония(NH4Br) – это средняя соль, которая при взаимодействии с щелочами дает гидроксид аммония, являющийся неустойчивым соединением и распадается на аммиак и воду. Также он реагирует с солями(если дает осадок). Ответ 2
Азотная кислота – самая удивительная кислота, которая являясь сильным окислителем, не дает ожогов, как серная кислота. Реагирует с огромным количеством соединений, среди которых
— металлы,
— неметаллы(сера, углерод, йод, фосфор),
— основания,
— соли,
— оксиды.
Важно! HNO3 никогда не выделяет водород при взаимодействии с металлами. Всегда выделяются соединения азота – от солей аммония до NO2.
Здесь подходит вариант ответа 3.
Гидроксид бария(Ba(OH)2) – это щелочь, которая проявляет типичные свойства всех подобных веществ, вступая в реакцию с кислотами, кислотными оксидами, солями.
Ответ 1.
Натрий – крайне опасный щелочной металл, который нельзя даже держать в руке по причине разъедания кожных покровов. Na вступает в экзотермическую реакцию с водой при комнатной температуре, при этом реакция идет достаточно бурно с выделением чистого водорода.
Как и все щелочные металлы, он реагирует с неметаллами(сера, галогены), кислотами, солями.
Ответ 5.
Задание 6:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) сера
Б) кислород
В) хлор
Г) фосфор
Реагенты:
1) H2S, KOH, C2H6
2) O2, SO3, C2H6
3) CH4, Zn, N2
4) Hg, HNO3, Cl2
5) O2, S, Cl2
Решение:
Сера — неметалл желтого цвета, реагирует со многими веществами, например,
— с кислородом(образуя SO2, SO3),
— с водородом(H2S),
— с углеродом(CS2),
— с галогенами(SCl2 – при расплаве, SF6 – при комнатной t),
— металлами(ртуть, натрий, железо).
Ответ 4
Кислород(O2) – главный неметалл для реакций горения, главный окислитель, главный элемент для органической жизни. Этот неметалл способен к огромному числу реакций как с простыми, так и со сложными веществами.
В данном варианте нам подходит вариант ответа 3.
Хлор(Cl2) – галоген, способный реагировать с щелочами, некоторыми кислотами(H2S), металлами, неметаллами.
Ответ 1.
Фосфор(P) — это типичный неметалл, имеет три аллотропические модификации в виде белого(ядовитого), красного и черного фосфора, вступает в реакции со многими веществами, в частности, реагирует
— с неметаллами(кислородом, водородом, серой, галогенами),
— с металлами(образует фосфиды),
— с водой(водяным паром при t > 500 C),
— с щелочами,
— с сильными кислотами.
Ответ 5.
Задание 7:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Ba(OH)2
Б) ZnO
В) Ag
Г) NH4Cl
Реагенты:
1) C, HCl, KOH
2) O2, Br2, HNO3
3) CO, CaCl2, SO2
4) HBr, Zn(OH)2, K2CO3
5) AgNO3, Sr(OH)2, H2SO4 (конц.)
Решение:
Гидроксид бария(Ba(OH)2) — это щелочь, которая проявляет типичные свойства всех растворимых оснований, вступая в реакцию с кислотами, кислотными оксидами, солями.
Ответ 4
Оксид цинка(ZnO) – это амфотерный оксид, нерастворим в воде, не токсичен, реагирует с щелочами, кислотами, кислотными оксидами, неметаллами; ответ 1
Серебро(Ag) – это неактивный благородный металл, взаимодействует с азотной кислотой, серой, галогенами, кислородом(при нагревании), ответ 2
Хлорид аммония(NH4Cl) – это средняя соль, хорошо растворимая в воде, имеет все свойства растворимых солей, плюс в реакциях со щелочами выделяет аммиак и воду за счет неустойчивости гидроксида аммония, ответ 5.
Задание 8:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Si
Б) SrO
В) HNO3
Г) Ca(HCO3)2
Реагенты:
1) CuSO4, O2, SO2
2) O2, Mg, NaOH
3) Cu, Ba(OH)2, MgCO3
4) CO2, ZnO, H3PO4
5) H3PO4, HBr, Ca(OH)2
Решение:
Кремний(Si) – неметалл, обладает схожими с углеродом свойствами, с трудом вступает в реакции при обычных условиях, способен реагировать
— с кислородом,
— с металлами(с образованием силицидов),
— с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + H2↑
Ответ 2
Оксид стронция(SrO) – это основный оксид, хорошо растворяется в воде, реагирует как и все основные оксиды щелочно — земельных металлов с кислотами, кислотными оксидами, солями, амфотерными соединениями; ответ 4
Азотная кислота(HNO3) – уже была расписана выше, в данном варианте выбираем пункт 3.
Гидрокарбонат кальция(Ca(HCO3)2) – это кислая соль, которая проявляет свойства растворимых кислот, при этом реагирует с гидроксидом кальция:
Ca(HСО3)2 + Cа(OН)2 = 2CaCO3 + 2H2O
Ответ 5
Задание 9:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) P4
Б) Fe2O3
В) Cu2O
Г) NH4Cl
Реагенты:
1) HCl, HNO3, K2CO3
2) O2, Zn, NaOH (р-р)
3) CaCl2, AgNO3, CO
4) O2, CO, HCl
5) H2SO4 (конц.), NaOH, Pb(NO3)2
Решение:
Фосфор(P4) – это формула белого фосфора, имеет такое обозначение за счет тетраэдрической структуры молекулы данной аллотропии; белый фосфор реагирует с кислородом, металлами, щелочами(с образованием фосфина), с кислотами.
Ответ 2
Оксид железа(Fe2O3) – это амфотерный оксид железа, красно-коричневого цвета, нерастворим в воде, реагирует с кислотами, солями, щелочами, водородом(восстановление).
Ответ 1.
Оксид меди(Cu2O) – представляет собой нерастворимый в воде оксид красно-бурого цвета, реагирует при относительно невысоких t с кислотами(серной, азотной, соляной); при высоких t
— с металлами(Al),
— с неметаллами(O, H, S, галогены),
— с аммиаком,
— c угарным газом:
Cu2O + CO = 2Cu + CO2
— с оксидами щелочных металлов:
Cu2O + BaO = BaCu2O2.
Ответ 4
Хлорид аммония(NH4Cl) — это средняя соль, хорошо растворимая в воде, имеет все свойства растворимых солей, плюс в реакциях со щелочами выделяет аммиак и воду за счет неустойчивости гидроксида аммония, ответ 5
Задание 10:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) CO2
Б) CuCl2
В) NH3
Г) FeS2
Реагенты:
1) HNO3, HBr, O2
2) AgNO3, Na2S, NaI
3) Mg, CaO, H2O
4) KOH, H2SO4, FeS
5) H2SO4, O2, Na2SO4
Решение:
CO2 – составляющая часть воздуха и выделяемого нашим организмом газа в результате энергетического обмена, этот газ является солеобразующим кислотным оксидом, который взаимодействует
— с основными оксидами,
— основаниями,
— водой,
— с некоторыми металлами:
2Mg + CO2 = 2MgO + C
Ответ 3
Хлорид меди(CuCl2) – средняя соль, растворимая в воде, проявляет типичные свойства солей, реагируя с кислотами, щелочами, а также с солями сульфидов и йодидов, при взаимодействии с которыми выделяются соответствующие нерастворимые соединения.
Ответ 2
Аммиак(NH3) – это водорастворимый токсичный газ, проявляющий основные свойства, тем самым легко вступает в реакции с кислотами(серной, азотной), окисляется кислородом с образованием двух разных продуктов азота:
4NH3 + 3O2 = 2N2 + 6H2O(сгорание)
4NH3 + 5O2 = 4NO + 6H2O
Ответ 1
Дисульфид железа(FeS2) – это средняя соль, которая является составляющей частью минерала пирита; способна разлагаться на отдельные элементы под действием высокой t(1170 С), реагирует с азотной, серной и другими кислотами, а также окисляется кислородом до оксида Fe(III).
Ответ 1
На сегодня все!




 Азот на ЕГЭ
Азот на ЕГЭ