Полный курс подготовки к ОГЭ по химии-2022. Здесь приведена теория по каждому заданию ОГЭ по химии в соответствии с кодификатором. Вся теория, необходимая для подготовки к ОГЭ по химии.
Кодификатор ОГЭ по химии-2022
| 1 | Вещество | |
| |
1.1. | Строение электронных оболочек атомов элементов первых 20 элементов Периодической системы Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1 | Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента |
|
| 1.2.2 |
Закономерности изменения свойств элементов и их соединений в связи с их положением в Периодической системе химических элементов Д.И. Менделеева |
|
|
Строение веществ. Химическая связь |
||
| 1.3 | Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная связь, металлическая связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.4 | Валентность химических элементов. Степень окисления химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| Первоначальные химические понятия | ||
| 1.5 | Чистые вещества и смеси | |
| 1.6 | Атомы и молекулы. Химический элемент. Простые и сложные вещества. Относительная атомная и молекулярная масса | |
| 1.7 | Классификация и номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2 | Химическая реакция | |
| 2.1 | Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях | |
| 2.2 | Классификация химических реакций по различным признакам: количеству и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии | |
| 2.3. | Электролиты и неэлектролиты | |
| 2.4. | Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних) | |
| 2.5. | Реакции ионного обмена и условия их осуществления | |
| 2.6. | Окислительно-восстановительные реакции. Окислитель и восстановитель | |
| 2.7. | ||
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | Элементарные основы неорганической химии. Представления об органических веществах | |
| 3.1 | Химические свойства простых веществ | |
| 3.1.1 | Химические свойства простых веществ – металлов: щелочных, щелочноземельных, алюминия, железа. | |
| 3.1.2 | Химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 3.2 | Химические свойства сложных веществ |
|
| 3.2.1 | Получение и химические свойства оксидов: основных, амфотерных, кислотных | |
| 3.2.2 | Получение и химические свойства оснований. Химические свойства амфотерных гидроксидов алюминия и железа (III) | |
| 3.2.3 | Получение, применение и химические свойства кислот | |
| 3.2.4 | Химические свойства солей | |
| 3.3 | Генетическая связь между классами неорганических соединений | |
| 3.4 | Первоначальные сведения об органических веществах | |
| 3.4.1 | Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен | |
| 3.4.2 | Кислородсодержащие вещества: спирты (метанол, этанол, глицерин), карбоновые кислоты (уксусная и стеариновая) | |
| 3.4. | Биологически важные вещества: белки, жиры, углеводы | |
| 4. | Методы познания веществ и химических явлений. Экспериментальные основы химии | |
| 4.1. | Экспериментальные основы химии | |
| 4.1 | Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование.
Способы разделения смесей. Приготовление растворов с определённой массовой долей растворённого вещества |
|
| 4.2 | Определение характера среды раствора кислот и щелочей с помощью индикаторов.
Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония). |
|
| 4.3 | Получение газообразных веществ.
Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак) |
|
| 4.4 | Решение экспериментальных задач по темам «Неметаллы IV–VII групп и их соединений»; «Металлы и их соединения»
Получение и изучение свойств изученных классов неорганических веществ |
|
| 4.5 | Проведение расчётов на основе формул и уравнений реакций | |
| 4.5.1 | Вычисление массовой доли химического элемента в веществе | |
| 4.5.2 | Вычисление массовой доли растворённого вещества в растворе | |
| 4.5.3 | Вычисление количества вещества, массы или объёма вещества по количеству вещества, массе или объёму одного из реагентов или продуктов реакции | |
| 5. | Химия и жизнь | |
| 5.1 | Проблемы безопасного использования веществ и химических реакций в повседневной жизни | |
| 5.2 | Химическое загрязнение окружающей среды и его последствия |
|
| 5.3 | Человек в мире веществ, материалов и химических реакций
Токсичные, горючие и взрывоопасные вещества |
Спецификация ОГЭ по химии-2022
Часть 1
Задание 1. Атомы и молекулы. Химический элемент. Простые и сложные вещества
Задание 2. Строение атома. Строение электронных оболочек атомов первых 20 химических элементов Периодической системы Д.И. Менделеева. Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
Задание 3. Закономерности изменения свойств элементов в связи с положением в Периодической системе химических элементов
Задание 4. Валентность. Степень окисления химических элементов
Задание 5. Строение вещества. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая
Задание 6. Строение атома. Строение электронных оболочек атомов первых 20 химических элементов Периодической
системы Д.И. Менделеева. Закономерности изменения свойств элементов в связи с положением в Периодической системе химических элементов
Задание 7. Классификация и номенклатура неорганических веществ
Задание 8. Химические свойства простых веществ. Химические свойства оксидов: основных, амфотерных, кислотных
Задание 9. Химические свойства простых веществ. Химические свойства сложных веществ
Задание 10. Химические свойства простых веществ. Химические свойства сложных веществ
Задание 11. Классификация химических реакций по различным признакам: количеству и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии
Задание 12. Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения.
Сохранение массы веществ при химических реакциях
Задание 13. Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щёлочей и солей (средних)
Задание 14. Реакции ионного обмена и условия их осуществления
Задание 15. Окислительно-восстановительные реакции. Окислитель и восстановитель
Задание 16. Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование. Разделение смесей и очистка веществ. Приготовление растворов. Проблемы безопасного использования веществ и химических реакций в повседневной жизни. Химическое загрязнение окружающей среды и его последствия. Человек в мире веществ, материалов и химических реакций
Задание 17. Определение характера среды раствора кислот и щёлочей с помощью индикаторов. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-, фосфат-, гидроксид- ионы; ионы аммония, бария, серебра, кальция, меди и железа). Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак).
Задание 18. Вычисление массовой доли химического элемента в веществе.
Задание 19. Химическое загрязнение окружающей среды и его последствия. Человек в мире веществ, материалов и химических реакций.
Часть 2
Задание 20. Окислительно-восстановительные реакции. Окислитель и восстановитель.
Задание 21. Взаимосвязь различных классов неорганических веществ. Реакции ионного обмена и условия их осуществления.
Задание 22. Вычисление количества вещества, массы или объёма вещества по количеству вещества, массе или объёму одного из реагентов или продуктов реакции. Вычисление массовой доли растворённого вещества в растворе.
Практическая часть
Задание 23. Решение экспериментальных задач по теме «Неметаллы IV–VII групп и их соединений»; «Металлы и их соединения». Качественные реакции на ионы в растворе (хлорид-, иодид-, сульфат-, карбонат-, силикат-, фосфат-; ион аммония; катионы изученных металлов, а также бария, серебра, кальция, меди и железа).
Задание 24. Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование. Разделение смесей и очистка веществ. Приготовление растворов.
Химия
В помощь сдающим ОГЭ
методическое пособие по химии
для учащихся 9-х классов,
Тема №1: «Строение атомов первых 20 химических
элементов
ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
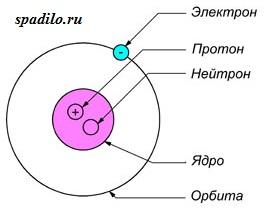
Строение атома: ядро (протоны и нейтроны) + электроны.
Число протонов (p+) – равно порядковому номеру химического элемента (Z).
Число нейтронов (n0) – равно A—Z, где А –
массовое число.
Число электронов (е—) — равно порядковому
номеру химического элемента (Z).
Заряд ядра = число протонов = число электронов (+Z = p+
= е—).
Номер периода показывает – число электронных слоев в
электронной оболочке атома.
Номер группы показывает – число электронов на внешнем
электронном слое атома + число валентных электронов.
Валентные электроны – электроны, участвующие в образовании химической связи.
Распределение электронов по энергетическим уровням: на
1-м максимум 2 электрона, на 2-м – 8 электронов, на 3-м – 18 электронов (если
уровень последний – то число электронов на нём равно номеру группы или
высчитывается как разница общего числа электронов и электронов на предыдущих
уровнях). Если последний (внешний) уровень атома имеет максимальное число
электронов, то такой электронный слой называется завершенным (его имеют атомы
благородных газов – элементы 8 группы).
Тема №2: «Периодический
закон и ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Закономерности
изменения свойств элементов и их соединений.
В
периоде слева направо:
1.
Радиус атома уменьшается;
2.
Металлические свойства ослабевают;
3.
Неметаллические свойства
возрастают;
4.
Восстановительные свойства
ослабевают;
5.
Окислительные свойства возрастают;
6.
Электроотрицательность возрастает;
7.
Число валентных электронов
возрастает;
8.
Основные оксиды через амфотерные
сменяются кислотными.
В
группе сверху вниз:
1.
Радиус атома возрастает;
2.
Металлические свойства возрастают;
3.
Неметаллические свойства
ослабевают;
4.
Восстановительные свойства
возрастают;
5.
Окислительные свойства ослабевают;
6.
Электроотрицательность
уменьшается;
7.
Число валентных электронов
постоянно и равно номеру группы.
Тема №3: «Химическая связь».
Обязательный минимум знаний.
Типы
химических связей:
1.
Ковалентная полярная химическая
связь (образуется между атомами неметаллов с разным значением
электроотрицательности или между атомами металла и неметалла с небольшой
разностью в значении электроотрицательности). Например: H2S, NH3.
2.
Ковалентная неполярная химическая
связь (образуется между атомами неметаллов с одинаковым значением
электроотрицательности). Например: H2, O2, P4, S8.
3.
Ионная химическая связь
(образуется между атомами неметалла и металла). Например: NaCl,
CaO, K2S.
4.
Металлическая химическая связь –
характерна для металлов и сплавов. Например: Al, Cu, бронза,
чугун, латунь.
Тема №4: «Степень окисления химических элементов».
Обязательный минимум знаний.
Правила
расчета степени окисления:
1.
С.о. водорода = +1 в соединениях с
неметаллами и = -1 в соединениях с металлами (гидриды металлов);
2.
С.о. кислорода = -2, кроме
пероксидов (-1) и фторидов (+2);
3.
С.о. металла = заряду его иона (в
таблице растворимости);
4.
С.о. простого вещества = 0;
5.
Сумма с.о. всех элементов в
сложном веществе = 0;
6.
С.о. иона = заряду иона (в таблице
растворимости).
Алгоритм
определения степени окисления элементов в бинарных соединениях:
1.
Выбрать более электроотрицательный
элемент и найти его степень окисления, как № группы – 8. Написать над ним
степень окисления.
2.
Умножить степень окисления на
индекс у этого элемента. Полученное число со знаком «минус» подписать под
другим элементом.
3.
Такое же число со знаком «плюс»
подписать под другим элементом.
4.
Разделить это число на индекс
другого элемента. Полученную степень окисления написать над элементом.
Алгоритм
определения степени окисления неметалла в кислотах и солях:
1.
Отделить кислород вертикальной
чертой, записать сверху его степень окисления – 2 и умножить на индекс.
Полученное число написать под кислородом.
2.
Такое же число с противоположным
знаком записать под левой частью формулы.
3.
Вычесть из него число атомов
водорода (для кислот) или заряд металла*индекс металла (для солей). Полученное
число написать над знаком центрального элемента.
Тема №5: «Простые и сложные вещества. Основные классы
неорганических веществ. Номенклатура органических соединений».
Обязательный минимум знаний.
Классификация веществ
Вещества
Простые Сложные
Металлы Неметаллы Оксиды Основания
Кислоты Соли
Оксиды –
бинарные соединения кислорода, в котором он проявляет степень окисления –2 (CaO, Al2O3).
Классификация оксидов.
Оксиды
несолеобразующие
солеобразующие
CO, N2O, NO, SiO, S2O
основные амфотерные кислотные
Несолеобразующие оксиды – не взаимодействуют с
кислотами и щелочами и, как следствие, не образуют солей. Основные оксиды
– образованы металлом в с.о.+1 и +2 (Na2O, MgO). Амфотерные
оксиды – образованы металлами в с.о. +3 и +4 (Al2O3, PbO2). Исключения: ZnO, PbO, SnO, BeO
(у них с.о. металла равна +2). Кислотные оксиды – образованы
металлом в с.о.+5,+6,+7 или неметаллов, исключая несолеобразующие (SO3, CO2).
Основания –
сложные соединения, в составе которых катион металла соединен с
гидроксид-анионами: Me(OH)n. Например: NaOH, Ca(OH)2.
Основания могут быть растворимыми и нерастворимыми. Растворимые в воде
основания – щелочи (они окрашивают индикаторы).
Кислоты –
сложные соединения, в составе которых атом водорода соединен с кислотным
остатком (HCl, H2SO4). Кислотный
остаток может состоять из одного элемента (Cl—) и быть сложным (SO4—).
Соли –
сложные вещества, в составе которых катион металла соединен с кислотным
остатком (NaCl, CaSO4).
Формулы и названия кислот и солей.
|
Формула кислоты |
Название кислоты |
Название соли |
Пример соли |
|
HF |
Фтороводородная (плавиковая) |
Фторид |
FeF3, |
|
HCl |
Хлороводородная (соляная) |
Хлорид |
CuCl2, |
|
HBr |
Бромоводородная |
Бромид |
MgBr2, |
|
HI |
Йодоводородная |
Йодид |
NaI, йодид |
|
H2S |
Сероводородная |
Сульфид |
FeS, сульфид |
|
H2SO3 |
Сернистая |
Сульфит |
Na2SO3, сульфит натрия |
|
H2SO4 |
Серная |
Сульфат |
BaSO4, |
|
HNO2 |
Азотистая |
Нитрит |
KNO2, |
|
HNO3 |
Азотная |
Нитрат |
Cu(NO3)2, нитрат |
|
H2CO3 |
Угольная |
Карбонат |
CaCO3, |
|
H2SiO3 |
Кремниевая |
Силикат |
Na2SiO3, силикат натрия |
|
H3PO4 |
Фосфорная |
Фосфат |
Ca3(PO4)2, фосфат кальция |
Тема №6: «Условия и признаки протекания химических
реакций. Химические уравнения».
Обязательный минимум знаний.
Физические
явления – явления, при которых состав
вещества остается постоянным, а изменяется лишь его агрегатное состояние или
форма и размеры тел. Примеры: плавление парафина, таяние льда, испарение воды.
Химические
явления (химические реакции)–
явления, при которых одни химические вещества превращаются в другие. Примеры:
горение древесины, ржавление металлов, скисание молока.
Химическое
уравнение – это условная запись
химической реакции с помощью химических формул и коэффициентов.
Признаки
химических реакций:
1.
Изменение цвета;
2.
Выделение тепла и света;
3.
Выделение газа;
4.
Растворение осадка;
5.
Изменение запаха;
6.
Выпадение осадка.
.
Тема №7: «Классификация химических реакций».
Обязательный минимум знаний.
Типы
химических реакций по числу и составу исходных и полученных веществ:
1.
Реакция разложения – это реакции, при которых из одного вещества
образуется несколько других. Например: Cu(OH)2 → CuO + H2O
2.
Реакция соединения – это реакции, при которых из нескольких веществ
образуется одно. Например: S +
O2 → SO2
3.
Реакция обмена – это реакции, при которых два сложных вещества
обмениваются своими составными частями. Например:
CuSO4 + BaCl2
→ BaSO4 + CuCl2
4.
Реакция замещения – это реакция между простым и сложным веществом, при
которой атомы простого вещества, замещают атомы одного из элементов в сложном
веществе. Например:
Zn + 2HCl → ZnCl2 + H2
Типы химических реакций по тепловому эффекту:
1.
Экзотермические – протекают с выделением теплоты;
2.
Эндотермические – протекают с поглощением теплоты.
По изменению степени окисления исходных веществ и
продуктов реакции:
1.
Окислительно-восстановительные
реакции (ОВР) – реакции, протекающие с изменением степени окисления;
2.
Не окислительно-восстановительные
реакции – реакции, протекающие без изменением степени окисления;
По участию катализатора:
1.
Каталитические – протекают с участием катализатора;
2.
Некаталитические – протекают без участия катализатора.
По обратимости:
1.
Обратимые – протекают в двух противоположных направлениях;
NaCl + HNO3 ↔ HCl +NaNO3
2.
Необратимые – протекают только в одном направлении.
NaCl
+ AgNO3 → AgCl↓
+ NaNO3
Тема №8: «Электролиты и неэлектролиты. Катионы и
анионы».
Обязательный минимум знаний.
Электролиты – вещества, растворы которых проводят электрический
ток. К электролитам относятся – растворимые кислоты, щелочи, соли.
Неэлектролиты
– вещества, растворы которых не
проводят электрический ток. К неэлектролитам относятся – нерастворимые кислоты,
основания, соли; оксиды; органические вещества: раствор сахарозы, метанол,
этанол, глюкоза.
Дополнительная
информация: Габриелян О. С., Химия 8 кл., 2008г., § 35.
Тема №9: «Электролитическая диссоциация кислот,
щелочей и солей».
Обязательный минимум знаний.
Положения
ТЭД:
1.
При растворении в воде электролиты
диссоциируют на положительные ионы (катионы) и отрицательные ионы (анионы).
2.
Под действие электрического тока
катионы движутся к катоду (-), анионы – к аноду (+).
3.
Диссоциация – обратимый процесс.
4.
Не все электролиты диссоциируют в
равной мере.
5.
Химические свойства электролитов
определяются свойствами тех ионов, которые они образуют при диссоциации.
Кислоты – электролиты, которые при диссоциации образуют
катионы водорода и анионы кислотного остатка. Например: HCl
→ H+ + Cl—
Основания – электролиты, которые при диссоциации образуют
катионы металла и гидроксид-анионы. Например: NaOH → Na+ + OH—
Соли — электролиты, которые при диссоциации образуют
катионы металла и анионы кислотного остатка. Например: NaCl → Na+ + Cl—
Это важно! При диссоциации индексы выносятся вперед ионов. Например: Al2(SO4)3
→ 2Al3+ + 3SO42-
Тема №10: «Реакции ионного обмена и условия их
осуществления».
Обязательный минимум знаний.
Взаимодействие кислот, оснований и
солей
кислота (р)
1р р
основание (р) соль
(р) ↓, ↑, H2O
р
Эта
схема показывает, что кислота может реагировать с основанием, если что-либо
одно из них растворимо; растворимая кислота может реагировать с солью; соли
между собой могут реагировать, если обе они растворимы; соль с основанием могут
реагировать, если и соль, и основание растворимы. Условия реакции – образование
осадка, газа или воды.
Алгоритм
составления реакций ионного обмена:
1.
Записать исходные вещества.
Подписать классы веществ.
2.
Проверить, являются ли они
электролитами (по таблице растворимости). По схеме определить, возможна ли
такая реакция.
3.
Если возможно, над ионами в
исходных веществах проставить заряды (по таблице растворимости).
4.
Поменять правые части формул
местами и записать, таким образом продукты реакции.
5.
Правильно составить формулы
продуктов. Для этого поставить заряды ионов, снести их крест-накрест и
сократить, если нужно.
6.
Расставить коэффициенты в
уравнении
7.
Под формулами продуктов реакции
подписать, являются ли они электролитами или неэлектролитами.
8.
Записать электролиты в виде ионов
с учетом индексов и коэффициентов; неэлектролиты оставить в молекулярном виде.
9.
В левой и правой части сократить
одинаковые частицы.
10.
Записать оставшиеся после
сокращения ионы и молекулы.
Условия
протекания реакций ионного обмена до конца (необратимо):
1.
Образуется осадок.
2.
Образуется газ.
3.
Образуется малодиссоциируемое вещество,
например вода.
Тема №11: «Химические свойства простых веществ:
металлов и неметаллов».
Обязательный минимум знаний.
+ неметалл → соль или оксид (1)
+ Н2О → Ме(ОН)n+H2 (если Ме от Li—Al) (2)
+ Н2О → Ме2Оn+H2 (если Ме от Mn—Cd) (3)
Металл + кислота →
соль (растворимая) + Н2 (Ме левее Н) (4)
+ соль → соль’ (растворимая)+ Ме (5)
+ Ме2Оn → Ме’ + Ме2Om
(6)
(1)
. Образуется бинарное соединение.
Металл пишется слева, неметалл справа. У металла с.о. равна +№ группы (есть
исключения), у неметалла с.о. равна № группы — 8.Например: 2Са + О2
→ 2Са+2О-2.
(2)
. Металлы от лития до натрия
реагируют с водой при комнатной температуре, остальные – при нагревании. 2Na + 2H2O → 2NaOH + H2.
(3)
. Данная реакция протекает при
нагревании. Zn + H2O → ZnO + H2.
(4)
.Данная реакция характерна только
для разбавленных кислот. Металлы, стоящие в ряду напряжений после водорода, с
разбавленными кислотами не взаимодействуют. Ещё одно условие данной реакции: в
результате неё должна быть образована растворимая соль. Mg +
2HCl → MgCl2 + H2. Это
важно!: азотная кислота по особому взаимодейстует с металлами (см. А.14).
(5)
. Zn + CuCl2 → ZnCl2
+Cu.
(6)
. 2Al
+ Cr2O3 → Al2O3 + 2Cr
Это важно! Особенности
химических свойств некоторых металлов:
1. Особенности щелочных
металлов (Li, Na, K):
·
При взаимодействии с кислородом
литий образует оксид Li2O, натрий образует пероксид Na2O2: 2Na + O2 → Na2O2.
·
С растворами кислот и солей не
взаимодействуют, т.к. в первую очередь будут вступать в реакцию с водой.
2.
Особенности алюминия:
·
При обычных условиях малоактивен,
т.к. покрыт прочной оксидной пленкой Al2O3 (большинство реакций идут при нагревании);
·
Является амфотерным металлом,
поэтому взаимодействует не только с растворами кислот, но и с щелочами, образуя
соль — алюминат:
2Al+2NaOH+2H2O→2NaAlO2+3H2↑
·
На холоду не взаимодействует с
концентрированными серной и азотной кислотами (пассивируется).
3.
Особенности железа:
·
Для железа характерно образование
двух соединений: Fe2+ и Fe3+;
·
Образование соединений железа:
|
+2 |
+3 |
|
1). С неметаллами |
|
|
Fe + S → FeS |
2Fe + 3Cl2 → 2FeCl3 |
|
3Fe |
|
|
2). C водой: |
|
|
3Fe + 4H2O → Fe3O4 |
|
|
3). С кислотами |
|
|
Fe + 2HCl → FeCl2 + H2↑ |
|
|
4). С солями: |
|
|
Fe + СuSO4 → FeSO4 |
Тема №12: «Химические
свойства оксидов: основных, амфотерных, кислотных».
Обязательный минимум знаний.
+H2O
кислота (р)
кислотные + щелочь соль +
H2O
Оксиды + соль
основные + кислота соль
+H2O
+ H2O щелочь
Это важно! Амфотерные оксиды будут сочетать свойства основных и
кислотных оксидов, т.е. будут вступать в реакции с щелочами и кислотами.
Дополнительная
информация: Габриелян О. С., Химия 8 кл., 2008г., § 40.
Тема №13: «Химические свойства оснований».
Обязательный минимум знаний.
+ кислотный оксид → соль + H2O
Щелочи
+ кислота → соль + H2O
Основания +
соль → соль + основание (↑,↓)
Нерастворимые
+ кислота → соль + H2O
нагревание → МеО + H2O
Тема №14: «Химические свойства кислот».
Обязательный минимум знаний.
+ Ме (до Н) → соль + Н2
+ основный/амфотерный оксид → соль + Н2О
Кислота + основание/амфотерный
гидроксид → соль + Н2О
+
соль → соль + кислота
(↓,↑)
!Особенности
взаимодействия азотной кислоты с металлами:
1.
Водород никогда не
выделяется;
2.
Металл в полученном нитрате имеет
максимальную степень окисления;
3.
На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni.
4.
Продукты реакции зависят от двух
факторов:
·
Активность металла;
·
Концентрация кислоты.
HNO3 (к) + Ме (I,
II группа, гл.подгр.)
→ нитрат + N2O + H2O
HNO3 (к) + Ме (остальные) → нитрат + NO2 +H2O
HNO3 (р) + Ме (I,
II группа, гл.подгр.) → нитрат + NH3 (или NH4NO3) + H2O
HNO3 (р) + Ме (остальные) → нитрат + NO + H2O
Например:
Дополнительная
информация: Габриелян О. С., Химия 8 кл., 2008г., § 38.
Ag + 2HNO3 (к) → AgNO3
+ NO2 + H2O.
!Особенности
химических свойств концентрированной серной кислоты:
1.
С металлами:
·
Может взаимодействовать с
металлами, стоящими в ряду напряжений после водорода;
·
Металл в полученном сульфате имеет
максимальную с.о.
·
Водород никогда не выделяется;
·
На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni.
H2SO4 (к) + Me (I, II группа, гл.подгр, Zn) → сульфат
+ H2S/S/SO2 +H2O
H2SO4 (к) + Me (остальные) → сульфат + SO2 + H2O.
2.
С неметаллами:
2H2SO4 (к) + C → CO2
+ 2SO2 + 2H2O
2H2SO4 (к) + S → 3SO2
+ 2H2O
3.
С органическими веществами:
обугливает бумагу, ткань, древесину, сахарозу.
Тема №15: «Химические свойства солей».
Обязательный минимум знаний.
+ Ме (левее) → соль + Ме’
+ кислота → соль + кислота’
Соли + щелочь
→ соль + основание’ (↑,↓).
+ соль → соль + соль’
Дополнительная
информация: Габриелян О. С., Химия 8 кл., 2008г., § 41.
Тема №16: «Первоначальные представления об
органических веществах».
Обязательный минимум знаний.
Общие
признаки органических веществ:
1.
Наличие углерода;
2.
Наличие в молекулах только
ковалентных связей;
3.
Валентность углерода всегда равна
четырем.
Основные классы органических веществ.
1.
Предельные углеводороды (алканы).
Общая формула CnH2n+2. Важнейшие представители алканов:
|
Формула |
Название |
|
CH4 |
Метан |
|
C2H6 |
Этан |
|
C3H8 |
Пропан |
|
C4H10 |
Бутан |
|
C5H12 |
Пентан |
Характерные реакции: замещение и окисление.
2.
Непредельные углеводороды
(алкены). Общая формула CnH2n. Важнейшие представители:
|
Формула |
Название |
|
C2H4 |
Этен (этилен) |
|
C3H6 |
Пропен (пропилен) |
|
C4H8 |
Бутен |
|
C5H10 |
Пентен |
Особенность строения: наличие двойной С-С связи.
Характерные реакции: присоединения и окисления.
3.
Непредельные углеводороды
(алкины). Общая формула CnH2n-2. Важнейшие представители:
|
Формула |
Название |
|
C2H2 |
Этин (ацетилен) |
|
C3H4 |
Пропин |
|
C4H6 |
Бутин |
|
C5H8 |
Пентин |
Особенность строения: наличие тройной С-С связи.
Характерные реакции: присоединения и окисления.
4.
Спирты. Общая формула CnH2n+1ОН. Важнейшие представители:
|
Формула |
Название |
|
CH3ОН |
Метанол (метиловый спирт) |
|
C2H5ОН |
Этанол (этиловый спирт) |
|
C3H5(ОН)3 |
Глицерин |
5.
Карбоновые кислоты. Общая формула CnH2n+1СООН. Важнейшие представители:
|
Формула |
Название |
|
НСООН |
Муравьиная кислота |
|
CH3СООН |
Уксусная кислота |
|
C17H35СООН |
Стеариновая кислота |
Характерны
все свойства кислот (взаимодействие с металлами, оксидами металлов,
основаниями, солями).
Тема №17: «Чистые вещества и смеси. Правила безопасной
работы в школьной лаборатории. Разделение смесей и очистка веществ».
Обязательный минимум знаний.
Химические
формулы соответствуют чистым веществам. Все изучаемы в школьном курсе
способы разделения смесей относятся к физическим.
Смесь – многокомпонентная система (воздух, нефть, морская
вода, стекло, бронза, молоко, лимонад).
Смеси
бывают однородными (нельзя увидеть границу раздела между веществами): раствор
сахара в воде и неоднородными (видна граница раздела между веществами): взвесь
мела в воде.
Способы разделения неоднородных смесей:
1.
Отстаивание (этим же методом можно разделить две несмешивающиеся
жидкости с помощью делительной воронки). Ускоряют отстаивание
центрифугированием;
2.
Фильтрование;
3.
Некоторые твердые смеси можно
разделить при помощи магнита (смесь железных и медных опилок, смесь железных
опилок и серы).
Способы разделения однородных смесей:
1.
Выпаривание;
2.
Перегонка (дистилляция).
Некоторые правила безопасной работы в химической
лаборатории:
1.
При растворении серной кислоты
нужно вливать её тонкой струей в воду и перемешивать;
2.
При работе с растворами едких
веществ необходимо надевать защитные перчатки и очки;
3.
Воспламенившиеся ЛВЖ (нефть,
спирт, ацетон) необходимо тушить песком;
4.
Опыты с получением токсичных
газообразных веществ (SO2, H2S, NO2) необходимо проводить в вытяжном шкафу.
Дополнительная
информация: Габриелян О. С., Химия 8 кл., 2008 г., § 23.
Тема №18: «Определение характера среды раствора кислот
и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе и на
газообразные вещества».
Обязательный минимум знаний.
Индикаторы
|
Кислая |
Нейтральная |
Щелочная |
|
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Лакмус |
красный |
фиолетовый |
синий |
|
Метилоранж |
розовый |
оранжевый |
желтый |
Качественные реакции
|
Хлорид-ион |
+ |
|
Сульфат-ион SO42- |
+ Ba2+ → BaSO4↓ |
|
Карбонат-ион CO32- |
+ H+ → CO2↑+H2O + Ca2+ → CaCO3↓ белый осадок |
|
Ион |
+ |
|
Кислород |
Загорание |
|
Водород H2 |
Хлопок |
|
Углекислый |
Горящая |
|
Аммиак NH3 |
По |
Тема №19: «Вычисление массовой доли химического
элемента в веществе».
Обязательный минимум знаний.
Вычисления производятся по следующей формуле:
ω = Ar∙n/Mr
∙ 100%, где Ar – атомная масса химического элемента; n – число атомов того элемента,
массовая доля которого находится; Mr – молярная масса молекулы.
Например: вычислите массовую долю кислорода в карбиде натрия. Решение:
1.
Составляем формулу карбида натрия: Na4C.
2.
Ar(Na)=23 г/моль; n(Na)=4; Mr(Na4C)=104г/моль.
3.
Подставляем в формулу и вычисляем: ω(Na)=23∙4/104
∙100% = 88,5%
4.
Ответ: 88,5%.
Задания части В.
Тема №1: «Периодический закон Д. И. Менделеева».
Обязательный минимум знаний.
См. тема №2 части А.
Тема №2: «Химические свойства простых веществ и
оксидов».
Обязательный минимум знаний.
Химические свойства неметаллов.
|
Как окислитель |
Как восстановитель |
|
|
H2 |
Щелочные металлы |
НеМе и МеО |
|
O2 |
Ме, неМе (большинство), неМеО (в которых степень окисления неМе |
F2 |
|
Галогены (F2, Cl2, Br2) |
Ме, H2 |
— |
|
S |
Ме, H2 |
O2, галогены, H2SO4 (к), HNO3(к) |
|
N2 |
Ме (в обычных условиях только с литией, с |
O2 (при температуре электрической дуги), галогены. |
|
P |
Ме, H2 |
O2, |
|
C |
Ме, H2 |
O2, галогены, МеО, H2SO4(к), HNO3(к) |
|
Si |
Ме, H2 |
O2, |
+ см. тема № 12 части
А.
Тема №3: «Окислительно-восстановительные реакции».
Обязательный минимум знаний.
Окислительно-восстановительные
реакции (ОВР) – реакции, в ходе которых атомы меняют степени окисления.
Восстановитель – элемент, отдающий электроны (в ОВР его степень
окисления повышается). Им может быть атом, ион, имеющий минимальную или
промежуточную степень окисления. Например: Zn0 – 2e— = Zn+2.
Окислитель – элемент, принимающий электроны (в ОВР его степень
окисления понижается). Им может быть атом, ион, максимальную или промежуточную
степень окисления. Например: S0 + 4e— = S+4.
Атом
или ион, имеющий промежуточную степень окисления, может проявлять как
восстановительные, так и окислительные свойства, т.е. проявлять
окислительно-восстановительную двойственность. Для элементов главных подгрупп
максимальная степень окисления = +№ группы; минимальная № группы – 8.
Восстановление – процесс принятия электронов.
Окисление – процесс отдачи электронов.
+ см. тема №4 части А.
Тема №4: «Химические свойства кислот, оснований и
солей».
Обязательный минимум знаний.
см. тема №13, 14, 15 части А.
Задания части С.
Тема №1: «Взаимосвязь различных классов неорганических
веществ».
Обязательный минимум знаний.
Схема
генетической связи веществ.
+O2 +H2O
металл основной оксид основание
соль
неметалл кислотный оксид кислота
соль
+O2 +H2O
Дополнительная информация: Габриэлян О. С., Химия 8 кл.,
2008г., § 42.
Тема №2: «Вычисление массовой доли растворенного
вещества в растворе».
Обязательный минимум знаний.
Алгоритм решения расчетных задач на нахождение массы
выпавшего осадка по уравнению реакции:
1.
Составить уравнение реакции,
уравнять его.
2.
По таблице растворимости
определить в правой части реакции осадок, обозначить его ↓.
3.
Рассчитать массу вещества в
растворе по формуле:
m(вещества)
= m(раствора)∙ω.
4.
Рассчитать количество вещества по
формуле: n = m/M.
5.
По уравнению реакции определить
количество вещества того вещества, которое выпало в осадок.
6.
Рассчитать массу осадка по
формуле: m = M·n.
Пример.
К 80 г раствора с массовой долей гидроксида натрия 5% добавили избыток раствора
сульфата меди (II). Определите массу выпавшего осадка.
Решение.
1.
Составляем уравнение реакции: NaOH
+ CuSO4 → Na2SO4 + Cu(OH)2.
2.
По таблице растворимости
определяем, что в осадок выпадает гидроксид меди(II), тогда
уравнение реакции принимает вид: NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓.
3.
Рассчитаем массу NaOH
по формуле m(вещества) = m(раствора)∙ω:
m(NaOH)=80г
· 0,05= 4г.
4.
Рассчитаем количество вещества NaOH
по формуле m = M·n:
n(NaOH)=
4г/40г/моль=0,1моль.
5.
По уравнению реакции определяем
(по коэффициентам перед веществами), что n(Cu(OH)2)=1/2n(NaOH)→n(Cu(OH)2)=0,05моль.
6.
Рассчитаем массу Cu(OH)2
(осадок) по формуле m = M·n:
m(Cu(OH)2)=
98г/моль∙0,05моль = 4,9г.
Ответ: 4,9 г.
Необходимые формулы:
1. m = M·n; n = m/M.
2. m(в-ва)=m(р-ра)·ω; m(р-ра)=m(в-ва)/ω.
3. V=Vm·n; n=V/Vm.
Теоретический материал
к алгоритму решения заданий ОГЭ по химии.
ЗАДАНИЕ №1. Cтроение атома и электронные оболочки
Все атомы состоят из ядра и электронной оболочки. Ядро поэтому так и называется, так как оно расположено в самом центре и очень-очень маленькое. Ядро заряжено положительно. Положительный заряд ядру придают протоны — положительно заряженные элементарные частицы. Один протон несет в себе заряд +1. Таким образом, сколько в ядре протонов, таков и заряд ядра. Заряд ядра, а следовательно и количество протонов показывает нам порядковый номер элемента в таблице Менделеева. Если порядковый номер 2, то заряд ядра равен двум — это ядро гелия — второго элемента в периодической таблице.
Порядковый номер элемента показывает также и количество электронов в электронной оболочке. Электронная оболочка окружает ядро и компенсирует положительный заряд ядра отрицательными зарядами электронов. Более того, электронная оболочка обуславливает протекания всех химических реакций — именно изменение состава электронной оболочки и её конфигураций объясняет природу химических реакций. Как и ядро, оболочка состоит из элементарных частиц — электронов. Электроны, в отличии от протонов, несут заряд -1 — электронная оболочка заряжена отрицательно. Но кроме этого, есть еще одно важное отличие электрона от протона — протон имеет вес 1, а электрон не имеет веса (на самом деле это не так, но для решения задач нам не понадобятся знания о массах элементарных частиц).
Кроме протонов, в ядре содержатся нейтроны — незаряженные элементарные частицы с массой 1. Они придают только вес атому и ядру, но не заряд. Количество нейтронов можно найти, зная массу элемента и его порядковый номер, так как порядковый номер показывает количество протонов и их суммарную массу, а молекулярная масса — общую массу. Таким образом, вычитая из общей массы массу протонов, мы получаем количество нейтронов.
Суммарный заряд атома нейтрален, отсюда следует, что количество протонов равно количеству электронов.
Электроны в оболочке расположены упорядочено — слоями. Количество слое определяет номер периода в периодической таблице.
Число слоев определяется номер периода, в котором стоит элемент.
В первом периоде может быть максимально два электрона, во втором — восемь, в третьем — восемь. Заполнение электронных оболочек первых трех периодов идет постепенно — сначала полностью заполняется первый, потом полностью второй и третий.
Число свободных неспаренных электронов определяется по формуле 8-n, где n – номер группы, в которой стоит химический элемент.
ЗАДАНИЕ №2. Закономерности в таблице Д.И. Менделеева
Физический смысл порядкового номера:
-
порядковый номер равен числу протонов и электронов и заряду ядра
Физический смысл номера периода:
-
номер периода равен числу заполняемых электронных слоёв
Физический смысл номера группы:
-
номер главной подгруппы равен числу электронов на внешнем слое (валентных электронов)
В периоде слева направо ⇒
Увеличивается:
-
Заряд ядра атома
-
Электротрицательность
-
Неметаллические свойства
-
Число валентных электронов
-
Высшая степень окисления
-
Кислотные свойства гидроксидов, образованные элементами
-
Не меняется число электронных слоев
Уменьшается:
-
Радиус атома
-
Легкость отдачи электрона
-
Металлические свойства
-
Основные свойства гидроксидов, образованные элементами
Основные свойства соединений (оксидов, гидроксидов) уменьшаются, сменяются амфотерными, кислотные свойства (оксидов, кислородных кислот) увеличиваются.
В группе сверху вниз ⇓
Увеличивается:
-
Заряд ядра атома;
-
Радиус атома
-
Легкость отдачи электрона
-
Металлические свойства
-
Основные свойства гидроксидов, образованные элементами
-
Число электронных слоев
Основные свойства соединений (оксидов, гидроксидов) увеличиваются, кислотные свойства соединений (оксидов, кислородных кислот) уменьшаются;
Кислотные свойства бескислородных кислот увеличиваются.
Уменьшается:
-
Электроотрицательность
-
Неметаллические свойства
-
Кислотные свойства соединений (оксидов, кислородных кислот) уменьшаются
Не меняется число валентных электронов и степень окисления химических элементов в одной группе.
ЗАДАНИЕ №3. Химическая связь и строение молекул
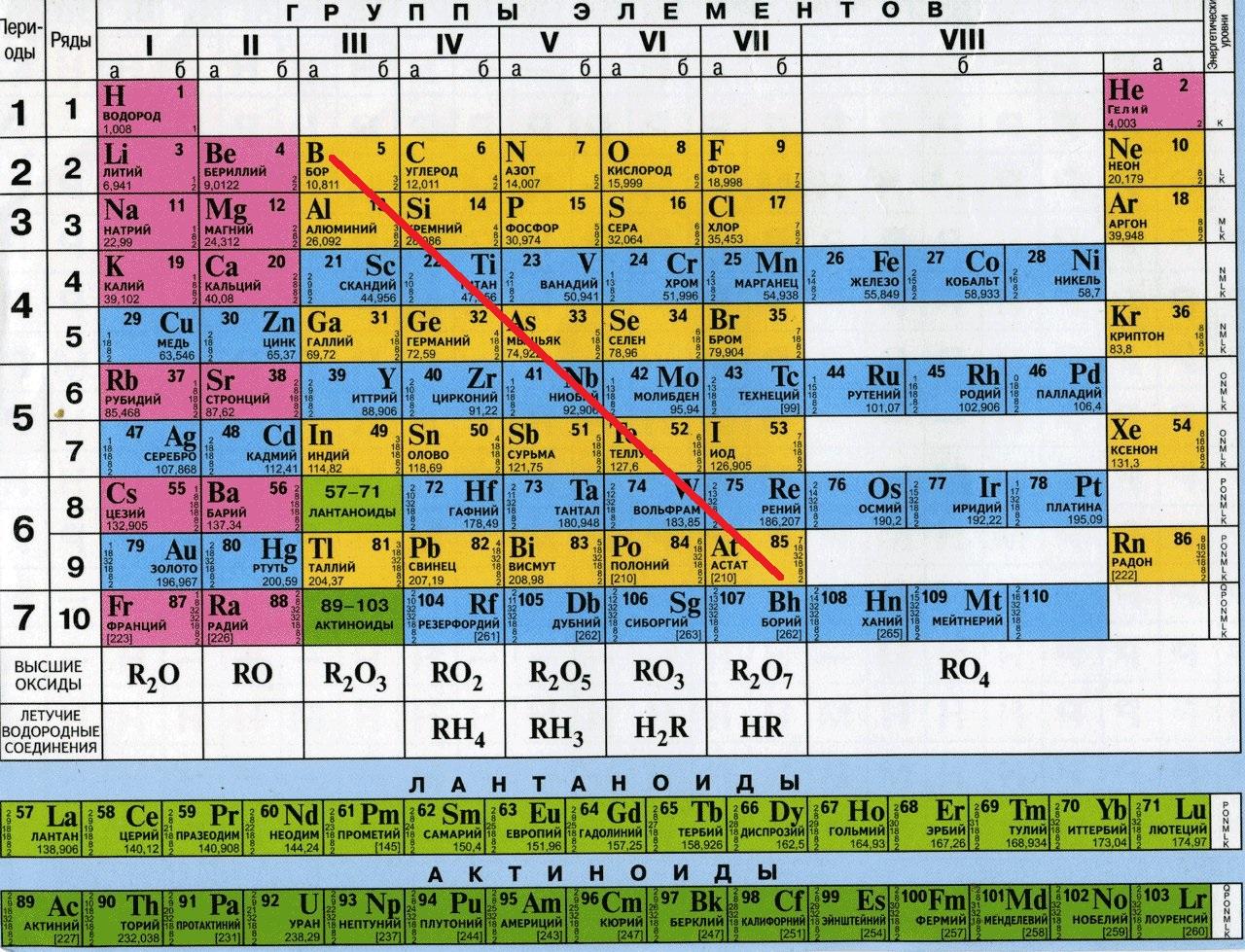
Вспоминаем классификацию простых веществ. Вещества делятся на металлы и неметаллы. Если провести диагональную линию от бора до астата в таблице Менделеева, то слева остаются металлы, справа — неметаллы. Деление довольно условное, но в школьном курсе мы руководствуемся именно этим.
Металлы
Итак, металлы образуют между атомами металлическую связь и формируют металлическую кристаллическую решетку, в узлах которой лежат ионны металлов, между узлами — ионами металлов распределен электронный газ — электроны. В данной системе нельзя сказать, какому конкретно иону принадлежит электрон — они распределены равномерно между всеми ионами. Именно этим и объясняется электропроводность металлов — электроны подвижны и распределение и движение зарядов происходит легко.
Неметаллы
Неметаллы располагаются справа от проведенной линии (кроме синих клеток на этой таблице — синие клетки это металлы). Неметаллы образуют друг с другом ковалентную связь. Если два атома неметалла представлены одним элементом, например атом хлора и еще один атом хлора образуют молекулу Cl2 — то это неполярная ковалентная связь. Если же атомы разные — то это ковалентная полярная связь — так как электронная плотность не может распределиться равномерным образом между двумя разными элементами (HCl, H2O, CO, P2O5, SO3). Молекулярная решетка в большинстве случаев молекулярная — H2, Cl2, O2, O3, S8, P4. В особых случаях — атомная — C, Si.
Аллотропия
Аллотропия — явление, образования одним элементом нескольких простых веществ:
-
углерод – алмаз, графит, карбин, фуллерен
-
кислород – кислород O2 и озон O3
-
фосфор- белый, красный, черный
-
олово – серое и белое
-
сера – пластическая и кристаллическая
То есть атомы одного элемента могут объединяться по-разному — из-за этого возникают новые или другие свойства.
ЗАДАНИЕ №4. Степень окисления и валентность Сравнение степени окисления валентности
|
Степень окисления |
Валентность |
|
|
Определение |
Условный заряд атома в молекуле, вычисленный исходя из предположения, что все связи в молекуле – ионные. |
Число химических связей, которые образует атом в химическом соединении. |
|
Знак |
Имеет знак – она может быть отрицательной, нулевой или положительной. |
Валентность не имеет знака. |
|
Обозначение |
Арабские цифры со знаком |
Римские цифры |
|
Примеры |
Cl (-1), Fe (+3) |
N (V), C (IV) |
Правила подсчета степени окисления
-
Степень окисления элемента в составе простого вещества принимается равной нулю; если вещество в атомарном состоянии, то степень окисления его атомов также равна нулю.
-
Ряд элементов проявляют в соединениях постоянную степень (пример фтор (-1), щелочные металлы (+1), щелочноземельные металлы, бериллий, магний и цинк (+2), алюминий (+3)).
-
Кислород, как правило, проявляет степень окисления -2 (исключения: пероксид Н2О2(-1) и фторид кислорода OF2 (+2)).
-
Водород в соединениях с металлами (в гидридах) проявляет степень окисления -1, как правило, +1(кроме SiH4, B2H6).
-
Алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю, а в сложном ионе – заряду этого иона.
Высшая степень окисления равна номеру группы элемента в Периодической системе — пример: сера – элемент VI группы главной подгруппы высшая степень окисления +6.
Правило не распространяется на элементы I группы побочной подгруппы, степени окисления которых обычно превышают +1, а также на элементы побочной подгруппы VIII группы.
Не проявляют своих высших степеней окисления, равных номеру группы, элементы кислород и фтор.
Правила подсчета валентности
Валентные возможности атома определяются числом:
-
Неспаренных электронов.
-
Неподелённых электронных пар.
-
Вакантных валентных пар.
Примеры: Н –водород IА группа, имеет 1 валентный электрон, образует 1 ковалентную связь с каким-либо другим атомом. Валентность I.
ЗАДАНИЕ №5. Классификация веществ
вещества бывают простые и сложные. Простые состоят из атомов одного элемента — сложные из атомов различных элементов. Простые вещества в свою очередь делятся на металлы и неметаллы. У сложных веществ больше классов — оксиды, кислоты, основания, щелочи.
Классификация оксидов
Рассмотрим классификацию оксидов. Оксиды — это соединения кислорода с другими элементами. В зависимости от того, с каким элементом кислород образует соединение, оксиды делятся на основные, кислотные и амфотерные.
-
Основные оксиды образуют металлы в степенях окисления +1 и +2 (K2O, MgO)
-
Кислотные оксиды образуют преимущественно неметаллы (SO3, N2O5)
-
Металлы Zn и Al образуют амфотерные оксиды (ZnO, Al2O3)
Из всех правил есть исключения, но о них в другой раз. К тому же в ОГЭ и ЕГЭ данные исключения не фигурируют.
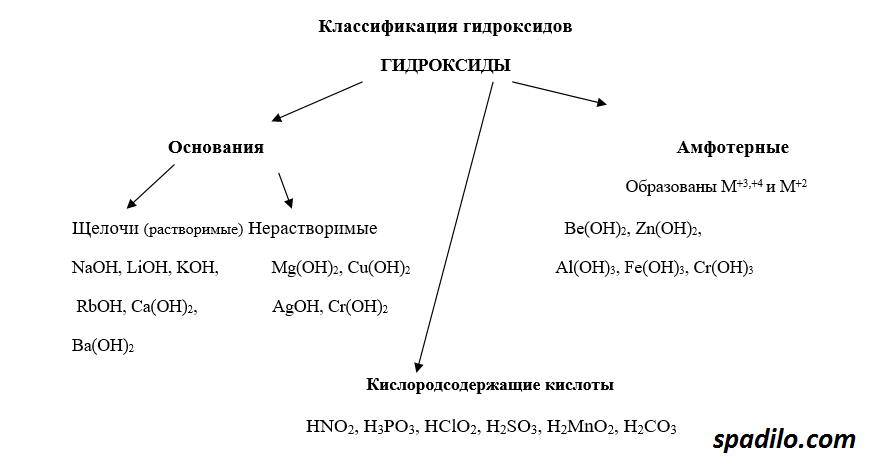
Классификация гидроксидов
Гидроксиды — продукты соединения оксидов с водой. В зависимости от того, какой был оксид, гидроксиды делятся на основания, кислоты и амфотерные основания. Основные оксиды образуют основания, кислотные, соответственно, кислоты, амфотерные оксиды образуют амфотерные основания — вещества, проявляющие свойства и кислот и оснований. В свою очередь основания делятся на растворимые — щелочи, и нерастворимые.
Классификация кислот
Кислоты имеют различные классификации. Существуют кислородсодержащие и бескислородные кислоты. Отличие первых от вторых состоит в том, что первые содержат в своей молекуле кислород, а вторые состоят только из элемента и водорода (HCl, например). Бескислородные кислоты образуются непосредственно при взаимодействии элемента (Cl2) и водорода (H2), в то время как кислородсодержащие кислоты образуются взаимодействием оксидов с водой.
Классификация по основности подразумевает количество протонов, отдаваемое молекулой кислоты при полной диссоциации. Одноосновные кислоты диссоциируют с образованием одного протона, двухосновные — двух, и так далее.
Классификация по степени диссоциации показывает, насколько легко проходит диссоциация (отрыв протона от молекулы кислоты). В зависимости от этого различают сильные и слабые кислоты.
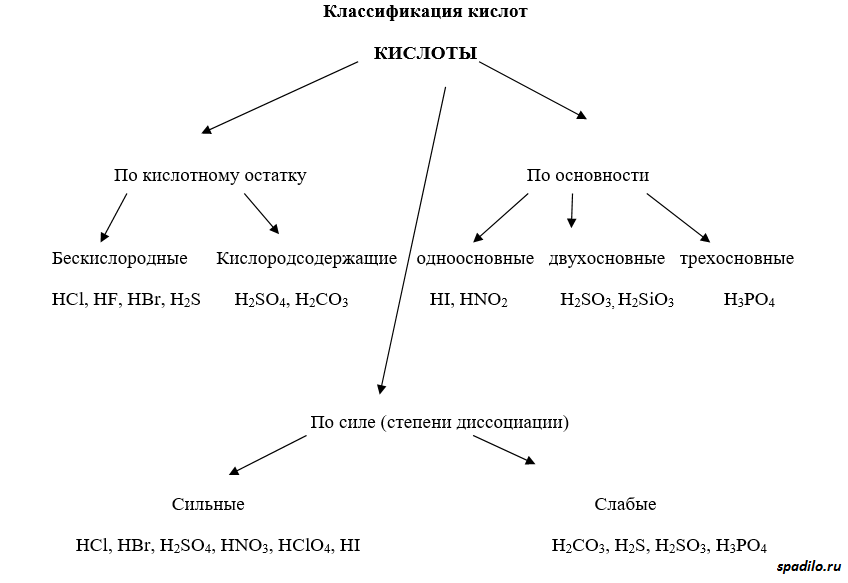
Соли делятся на средние, кислые и основные. В кислых солях присутствует протон, в основных — гидрокси-группа. Кислые соли представляют собой продукт взаимодействия избытка кислоты с основанием, основные соли — наоборот — продукт взаимодействия избытка основания с кислотой.
Подведем небольшой итог по пройденной теме.
-
Оксиды – сложные вещества, состоящие из двух химических элементов, один из которых — кислород.
-
Основания – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
-
Кислоты – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
-
Соли – это сложные вещества, состоящие из ионов металла и кислотных остатков.
ЗАДАНИЕ №6 — классификация химических реакций Химическая реакция
Химическая реакция — превращение одного или нескольких исходных веществ в другие вещества, при которых ядра атомов не меняются и образуются новые химические вещества.
Практически любая химическая реакция выражается химическим уравнением — оно показывает сколько молекул исходных веществ необходимо затратить, чтобы получить продукт. Таким образом, химическое уравнение — это условная запись химической реакции с помощью химических формул и знаков.
Правила записи химических уравнений
Сформулируем основные правила записи химических уравнений:
Основные правила для записи уравнения:
-
химическое уравнение составляют на основании закона сохранения массы веществ, поэтому число атомов каждого элемента в левой и правой частях уравнения должно быть равно друг другу
-
составление схемы реакции — для этого необходимо правильно записать формулы всех исходных веществ и соединить их знаком плюс, правильно записать формулы продуктов реакции
-
вычислить число атомов одного из элементов в левой части уравнения и сравнить с числом атомов этого элемента в правой, если эти числа не равны, то изменить уравнивающие коэффициенты перед формулами веществ и повторить этот шаг для каждого элемента в уравнении реакции
-
обязательно выполнить проверку правильности уравнивания, повторно сравнив количество атомов элементов
Классификация химических реакций
Перейдем к рассмотрению классификации химических реакций.
Классификация по типу превращений
Реакция соединения — химическая реакция, в результате которой из двух или большего числа исходных веществ образуется только одно новое.
Пример — получение сульфида меди из серы и меди:
Cu+S = CuS
Реакция разложения — химическая реакция, в результате которой из одного вещества образуется несколько новых веществ. В реакции данного типа вступают только сложные соединения, а их продуктами могут быть как сложные, так и простые вещества.
Пример — разложение карбоната кальция:
CaCO3 = CaO + CO2
Реакция замещения — химическая реакция,в результате которой атомы одного элемента, входящие в состав простого вещества, замещают атомы другого элемента в его сложном соединении. Как следует из определения, в таких реакциях одно из исходных веществ должно быть простым, а другое сложным.
Типичный пример — вытеснение более активным металлом менее активного из раствора его соли:
Zn + FeSO4 = ZnSO4 + Fe
Реакции обмена — реакция, в результате которой два сложных вещества обмениваются своими составными частями.
Типовые примеры — реакции осаждения либо нейтрализации:
HCl + KOH = KCl + H2O
Классификация по изменению степени окисления
Реакция может проходить как с изменением степени окисления атомов элементов, так и без. В первом случае реакции называются окислительно-восстановительными (ОВР). Хочу сразу отметить, что не бывает отдельно окислительных или восстановительных реакций. В реакции всегда присутствует и окислитель, и восстановитель.
Пример ОВР — окисление меди серой, приведен чуть выше.
Пример не ОВР — нейтрализация соляной кислотой гидроксида калия — также чуть выше.
Классификация по тепловому эффекту
Реакции могут либо отдавать тепло, либо забирать его.
Если реакция идет с выделением тепла — то её называют экзотермической (экзо — наружу).
Если наоборот, реакция идет с поглощением тепла — то её называют эндотермической (эндо — внутрь).
Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом. Его обозначают буквой Q («ку») и выражают в кДж.
-
Экзотермическая: C + O2 = CO2 + Q
-
Эндотермическая: CaCO3 = CaO + CO2 — Q
ЗАДАНИЕ №7 — электролитическая диссоциация Электролиты
Итак, электролиты — вещества, расплавы или растворы которых проводят электрический ток из-за диссоциации на ионы. Типичными электролитами являются кислоты, основания, соли.
Сильные электролиты
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора (сильные кислоты, такие как HCl, HBr, HI, HNO3,H2SO4).
От себя добавлю, что на самом деле степень диссоциации зависит от концентрации в любом случае, даже в растворах сильных кислот степень диссоциации не равна единице в сильно концентрированных растворах. Ну и если быть очень придирчивым, то единице степень диссоциация не может быть равна никогда, так как всегда найдется хотя бы одна молекула, которая не продиссоциировала. Но для ОГЭ мы считаем, что сильные электролиты всегда диссоциируют полностью со степенью равной единице.
Слабые электролиты
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. Примеры — вода, плавиковая кислота…
Сила электролита зависит во многом от растворителя.
Неэлектролиты
Неэлектролиты — вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
ЗАДАНИЕ №8 — реакции ионного обмена
Реакция ионного обмена — одна из видов химических реакций, продуктами которой являются вода, газ или осадок.
Иначе говоря, вещества обмениваются ионами только тогда, когда образуется либо газ, покидающий реакционную смесь, либо малорастворимое вещество — осадок или вода. Более профессиональным языком можно сказать, что движущей силой реакции ионного обмена является образование продукта иного агрегатного или фазового состояния в сравнении с реагентами.
На практике чаще всего мы сталкиваемся с реакциями в растворах, в результате которых образуется осадок, либо газ, либо вода. Чаще всего это реакции обмена.
Пример — реакция карбоната натрия и серной кислоты с выделением углекислого газа:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
В ионом виде:
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O
В сокращенном ионном виде:
CO32- + 2H+ → CO2↑ + H2O
Для успешного решения задач нам необходимо запомнить следующие правила:
-
используем таблицу растворимости: если видим, что продукт (то, что слева в уравнении) нерастворим, то реакция идет.
-
если видим в левой части газ (CO2, H2S, SO2 — типичные для ионного обмена), реакция идет.
-
если видим воду (H2O), реакция идет.
ЗАДАНИЕ №9 — свойства металлов и неметаллов
Химические свойства металлов
Для ОГЭ нам достаточно следующих знаний:
-
металлы реагируют с неметаллами всегда
-
металлы реагируют с кислотами
-
металлы реагируют с кислородом
Химические свойства неметаллов
-
неметаллы реагируют с металлами
-
неметаллы реагируют с водородом
-
неметаллы реагируют с кислородом
ЗАДАНИЕ №10 — химические свойства оксидов Химические свойства оксидов
-
оксиды реагируют с водой
-
основные оксиды реагируют с кислотами
-
кислотные оксиды реагируют с основаниями
-
амфотерные металлы и их оксиды — цинк и алюминий — реагируют и с кислотами, и с основаниями
-
основания реагируют как с кислотами, так и с амфотерными основаниями (цинк и алюминий)
-
кислоты реагируют как с основаниями, так и с амфотерными основаниями (цинк и алюминий)
Многие варианты построены на свойстве амфотерности, поэтому про алюминий и цинк необходимо помнить всегда.
ЗАДАНИЕ №11 — свойства кислот и оснований Кислоты
Напомню, что кислоты — это химические соединения, диссоциирующие на протоны (H+). Примеры простейших кислот — соляная (HCl), серная (H2SO4), азотная (HNO3).
Основания
Основания же — вещества, диссоциирующие на гидроксид ионы (OH-).
Простейшими примерами являются едкий калий и натрий (KOH и NaOH). Едкими их называют, кстати, неспроста. Они действительно разъедают и щиплют при попадании на кожу. Поэтому опасность их не стоит недооценивать.
Итак, перейдем к рассмотрению химических свойств данных классов.
Химические свойства кислот
Классификацию кислот мы рассматривали в разборе 5 задания ОГЭ по химии. Я рекомендую перед дальнейшем изучением химических свойств вспомнить классификацию кислот для общего понимания.
Итак, перейдем к рассмотрению свойств кислот:
-
реакция с основными оксидами: в качестве примера приведена реакция оксида кальция с соляной кислотой. В данной реакции продуктами являются соль — хлорид кальция, которым посыпают дороги в гололёд, и вода, которую мы пьем каждый день.
-
реакция с амфотерными оксидами, например оксидом цинка:
-
реакция кислот со щелочами носит название нейтрализации. Как пример, приведена реакция едкого натра с соляной кислотой, продуктами являются соль (в данном примере поваренная) и вода.
-
обменные реакции с солями, если в результате реакции образуется нерастворимое вещество либо газ. В качестве примера приведена реакция хлорида бария с серной кислотой, в результате которой образуется осадок сульфата бария и летучий хлороводород.
-
реакция с нерастворимыми основаниями, например гидроксида меди с серной кислотой:
-
вытеснение слабых кислот из растворов их солей, например солей фосфорной кислоты хлороводородной кислотой:
-
реакция с металлами, стоящими в ряду напряжений до водорода — пример — реакция магния с соляной кислотой:
Химические свойства оснований
Перед изучением химических свойств оснований, полезно вспомнить классификацию оснований из 5 задания ОГЭ по химии.
Итак, перейдем к разбору химических свойств оснований:
-
вышеприведенная реакция с кислотами — реакция нейтрализации
-
реакция с амфотерными основаниями, например, гидроксидом цинка и алюминия:
-
реакция с кислотными оксидами с образованием соли и воды. Пример — реакция едкого натрия с оксидом кремния (травление стекла):
-
обменные реакции с солями, если образуется осадок или газ (аммиак). Пример — реакция гидроксида бария с сульфатом натрия:
ЗАДАНИЕ №12 — химические свойства солей
Соли — вещества образованные ионом металла и кислотным остатком:
Основная масса заданий основана на обменных реакциях, о которые упомянуты в химических свойствах кислот и оснований. Если в результате реакции образуется осадок, либо газ, либо вода — то реакция идет. Также соли реагируют с металлами, стоящими левее металла, входящего в состав соли — то есть более активного.
ЗАДАНИЕ №13 — чистые вещества и смеси Чистые вещества
Чистые вещества (или индивидуальные вещества) — вещества, которые состоят из молекул или атомов одного вида.
Смеси
Смеси — системы, состоящие из двух и более веществ.
На многих сайтах и общеобразовательных порталах, даже на википедии до моей правки, смеси определяют как вещество, состоящее из нескольких веществ. Это в корне не верно. Вещество само по себе чистое вещество. А система из нескольких веществ называется смесью. Мои слова подтверждаются в англоязычной литературе и интернете, а на российских ресурсах возникает путаница.
Правила работы в школьной лаборатории Общие правила:
-
Работать в лаборатории необходимо в халате, а при проведении опытов с особо опасными веществами использовать респиратор, защитные очки и перчатки. Волосы должны быть убраны. (последний пункт особенно актуален для девушек)
-
Учащиеся могут находиться в химическом кабинете только в присутствии учителя.
-
Пребывание учащихся в помещении лаборантской запрещается.
-
Присутствие посторонних лиц в кабинете химии во время эксперимента допускается только с разрешения учителя.
-
Не допускается нахождение учащихся в кабинете химии во время его проветривания. (так как его проветривают от вредных газов!)
-
Учащимся запрещается бегать по кабинету, шуметь и устраивать игры.
-
Перед работой необходимо внимательно выслушать инструктаж учителя.
-
В кабинете химии запрещается принимать пищу и напитки.
-
Учащимся запрещается бегать самостоятельно проводить опыты, не предусмотренные в работе.
-
Запрещается самостоятельно устранять неполадки в оборудовании.
-
По окончании практической работы учащиеся должны помыть руки с мылом.
Требования при работе с веществами:
-
Щелочь и кислота моментально прожгут одежду и кожу.
-
Наливать и насыпать вещества нужно только над столом.
-
Наливать и насыпать вещества можно через воронку, кончик воронки должен касаться стенки пробирки.
-
Твердые сыпучие реактивы запрещено брать руками. Их измельчение производится с помощью пестика в ступке.
-
Химические вещества нельзя пробовать на вкус.
-
При определении запаха запрещается наклоняться над пробиркой. Нужно легкими движениями руки направить пар или газ к носу и осторожно вдыхать.
-
При разбавлении концентрированных кислот и щелочей небольшими порциями приливать кислоту (или концентрированный раствор щелочи) в воду, а не наоборот.
-
При встряхивании пробирки ее отверстие нельзя закрывать пальцем.
-
Перед нагреванием заполнять пробирку жидкостью более чем на 1/3 часть. Необходимо начинать со слабого нагревания сосуда. Пробирку нагревайте сначала всю, а только затем ту часть, где находится вещество.
-
Отверстие пробирки при нагревании направлять от себя и других.
-
В ходе нагревания запрещается заглядывать в сосуд и наклоняться над ним.
-
Запрещается вносить в кабинет и выносить из кабинета вещества и оборудование.
-
Запрещается излишек реактива ссыпать (выливать) обратно в банку (склянку).
-
Запрещается выливать в канализацию отработанные растворы. Остатки собираются в специально предназначенную посуду.
Требования при работе с нагревательными элементами:
-
Гасить спиртовку необходимо только накрывая пламя колпачком или крышкой.
-
Запрещается зажигать одну спиртовку от другой.
-
Запрещается передавать зажженную спиртовку.
-
Запрещается оставлять без присмотра нагревательные приборы.
Лабораторная посуда
-
пробирки (проведение опытов)
-
конические колбы (проведение опытов и хранение растворов веществ)
-
круглодонные колбы (перегонка жидкостей)
-
воронки (фильтрование неоднородных растворов)
-
аппарат Киппа (собирание газов)
-
колба Вюрца (отделение жидкостей с различной температурой кипения)
-
кристаллизатор (охлаждение веществ)
-
эксикатор (хранение токсичных или «влаголюбивых» веществ)
Мерная посуда
-
мензурка
-
мерная пробирка
-
мерный цилиндр
-
мерный стакан
Оборудование для взвешивания
-
технические весы
-
электронные весы
Оборудование для нагрева
-
штатив для пробирок
-
лабораторный штатив ( для закрепления химического оборудования)
-
ложечка для сжигания сухих веществ
-
тигельные щипцы (для удерживания химической посуды)
-
ручной держатель для пробирок
-
фарфоровая ступка (для размельчения сухих веществ)
-
тигли и фарфоровые чашки (для нагревания веществ до высокой температуры)
-
спиртовка
ЗАДАНИЕ №14 — степени окисления элементов
Степень окисления — условная величина, показывающая заряд атома в молекуле.
Степень окисления никогда не показывает реальный заряд атома — это условная величина, принимаемая нами для удобства рассчетов химических реакций.
Чтобы определить степень окисления атома в молекуле, следует пользоваться следующими правилами:
-
степень окисления водорода всегда +1 (исключение — гидриды металлов)
-
степень окисления кислорода всегда -2 (исключения — пероксиды и фториды)
-
степень окисления металлов первой группы +1, второй +2, алюминия +3
Окислитель — это атом или ион в молекуле, который забирает электроны.
Восстановитель — это атом или ион в молекуле, который отдает электроны.
Окислитель в ходе реакции восстанавливается, а восстановитель наоборот — окисляется!
Наиболее часто встречающимися окислителями являются кислоты, соли и оксиды с максимально положительной степенью окисления входящего в них элемента.
-
кислоты: HNO3, H2SO4, HClO4, H2Cr2O7
-
соли: KСlO4, KClO3, KNO3, KMnO4, K2Cr2O7
-
оксиды: PbO2, Mn2O7, CrO3, N2O5
-
активные неметаллы – фтор, хлор, кислород, озон
Наиболее часто встречающиеся восстановители:
-
металлы
-
вещества с минимально возможной (отрицательной) степенью окисления неметалла
— водородные соединения: NН3, HI, HBr, H2S
— соли: KI, NaBr, K2S
Составление окислительно-восстановительной реакции (ОВР)
Основное правило, которым мы должны руководствоваться при составлении ОВР:
Количество электронов, отданное восстановителем, равно количеству электронов, принятых окислителем.
Именно этот факт позволяет уравнять химическую реакцию.
ЗАДАНИЕ №15 — вычисление массовой доли
Молекулярная масса — масса молекулы, выраженная в атомных единицах массы.
Массовая доля (ω) химического элемента — отношение относительной атомной массы данного элемента с учетом всех его атомов в молекуле к относительной молекулярной массе вещества.
В формульном выражении это выглядит следующим образом:
-
ω(э) – массовая доля элемента
-
Ar(э) – относительная атомная масса элемента
-
n – число атомов элемента э в молекуле вещества
-
Mr – относительная молекулярная масса вещества
ЗАДАНИЕ №16 — периодический закон Менделеева
Для решения 16 задания ОГЭ по химии нам потребуются ровно те же знания, что и для решения второго задания, поэтому, чтобы не повторяться, нужно вспомнить теорию ко 2 заданию
ЗАДАНИЕ №17 — органические вещества
Органическая химия — химия соединений углерода.
Благодаря удивительному свойству атома углерода, возможно существование миллионов различных соединений, именующихся органическими.
Почему же углерод такой особенный?
Строение атома углерода
Оказывается, электронное строение атома углерода позволяет образовывать ему прочную связь с его же соседним атомом.
К слову, поэтому алмаз такой и прочный. В алмазе все вакантные позиции заняты его же атомами, а в органических соединениях это могут быть атомы водорода, кислорода, азота и прочих атомов.
Строение атома углерода делает возможным образование четырех связей.
В зависимости от того, сколько у углерода соседних атомов, он может образовывать с ними одинарную, двойную или тройную связь, меняя при этом гибридизацию атома.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
sp3 гибридизация
Если у атома углерода 4 соседа, то гибридизация его орбиталей sp3 и форма молекулы — тетраэдр.
Примеры соединений с sp3 гибридизацией — предельные соединения с одинарными связями — алканы, предельные спирты.
sp2 гибридизация
Если у атома углерода 3 соседа, то гибридизация его орбиталей sp2.
Примеры с sp2 гибридизацией — соединения с двойными связями — алкены, карбоновые кислоты, альдегиды и кетоны.
sp гибридизация
Если у атома углерода 2 соседа, то гибридизация его орбиталей sp и молекула линейна в данном месте.
Примеры с sp гибридизацией — соединения с тройной связью — алкины.
Выдержка из теории строения органических соединений:
-
атомы в молекулах соединены друг с другом в определённом порядке в соответствии с их валентностями
-
свойства веществ определяются не только их составом, но и химическим строением
Изомеры — вещества, имеющие одинаковый состав, но разное строение и разные свойства.
Свойство образовывать изомеры называется изомерией.
Гомологи — органические соединения одного класса, имеющие сходное строение и свойства, но разный количественный состав.
Химические свойства органических соединений
В 9 классе нам достаточно знать:
-
органические соединения сгорают до углекислого газа и воды
-
спирты являются жидкостями и реагируют со щелочными металлами
-
карбоновые кислоты реагируют с металлами и щелочами
ЗАДАНИЕ №18 — pH и качественные реакции Индикаторы
Индикатор — химическое вещество, меняющее окраску в зависимости от pH среды.
Самые известные индикаторы — фенолфталеин, метилоранж, лакмус и универсальный индикатор. Их цвета в зависимости от среды на картинке ниже:
А вот ещё цвета индикаторов более подробно с жизненными примерами:
С индикаторами мы разобрались, перейдем к качественным реакциям на ионы.
Качественные реакции на ионы
Качественные реакции на катионы и анионы представлены в таблице ниже.
Как правильно справиться с ЗАДАНИЕМ 8 в тесте ОГЭ по химии?
Для этого необходимо выбрать качественную реакцию на один из предоставленных вариантов и убедится, что данный реактив не вступает в реакцию со вторым веществом.
ЗАДАНИЕ №19 — химические свойства веществ
В 19 задании ОГЭ по химии нам необходимо вспомнить все химические свойства — как простых веществ, так и сложных.
Для этого нам необходимо вспомнить теорию следующих заданий:
-
химические свойства металлов и неметаллов
-
химические свойства оксидов
-
химические свойства кислот и оснований
-
химические свойства солей
-
качественные реакции
ЗАДАНИЕ №20 — метод электронного баланса Метод электронного баланса
Метод электронного баланса — метод уравнивания химических реакций, основанный на изменении степеней окисления атомов в химических соединениях.
Алгоритм наших действий выглядит следующим образом:
-
Вычисляем изменение степени окисления каждого элемента в уравнении химической реакции
-
Выбираем только те элементы, которые поменяли степень окисления
-
Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов
-
Находим наименьшее общее кратное для переданных электронов
-
Полученные значения и есть коэффициенты в уравнении (за редким исключением)
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HI + H2SO4 → I2 + H2S + H2O
Определите окислитель и восстановитель.
Итак, составляем электронный баланс. В данной реакции у нас меняют степени окисления сера и йод.
Сера находилась в степени окисления +6, а в продуктах — -2. Йод имел степень окисления -1, а стал 0.
Если у Вас возникли трудности с расчетом, то вспомните, как рассчитывать степень окисления.
1 | S+6 + 8ē → S–2
4 | 2I–1 – 2ē → I2
Сера забирает 8 электронов, а йод отдает только два — общее кратное 8, и дополнительные множители 1 и 4!
Расставляем коэффициенты в уравнении реакции согласно полученным данным:
8HI + H2SO4 = 4I2 + H2S + 4H2O
Не забываем указать, что сера в степени окисления +6 является окислителем, а иод в степени окисления –1 – восстановителем.
Начни онлайн-курс ОГЭ по химии прямо сейчас

Приложение Android
Начать подготовку
Приложение iOS
Начать подготовку
Краткая теория для подготовки ОГЭ химия.
Задания с кратким ответом. Ответы пишем в виде цифр на специальном бланке, писать по образцу в бланке аккуратно, проверяется сканированием автоматически.
Задание 1. Оценивается в 1 балл.
Уметь находить в тексте высказывание о простом веществе (физические: цвет, запах, объём плотность, растворимость, электропроводность и т.д,, хим свойства: реакция с другими веществами, применение, входит в состав смесей) и химическом элементе (описание строение атома: количество электронов, протонов, нейтронов, заряд ядра, радиус, масса атома, степень окисления, валентность, входит в состав соединений- веществ с конкретной хим формулой)
Задание 2. Оценивается в 1 балл.
Строение атома.
Порядковый номер химического элемента совпадает с зарядом ядра, количеством протонов, общим количеством электронов. Номер периода совпадает количеством слоев в атоме (энергетических уровней). Номер группы с количеством внешних (валентных) электронов.
Задание 3. Оценивается в 1 балл.
Свойства веществ в таблице Д.И. Менделеева. Радиус атома растет влево (в периоде) и вниз (в группе) в таблице Менделеева, чем больше радиус, тем ярче выражены металлические (восстановительные) свойства элементов. Самый сильный металл- франций. Чем меньше радиус, чем сильнее неметаллические (окислительные) свойства и больше электроотрицательность. Самый сильный неметалл- фтор. Инертные газы (VIII) главной подгруппы не активны (инертны), практически ни с чем не реагируют, так как у них завершенный внешний электронный слой- 8 электронов.
Задание 4. Оценивается в 2 балла.
Степень окисления и валентность (чаще всего численно совпадают, например, в хлорной кислоте HCIO4 степень окисления хлора +7 и валентность- VII)
Элементы I-III групп имеют постоянную (+) степень, равную номеру группы, кроме меди (+1,+2) и водорода (+1), но с металлами водород (-1)
Кислород (-2) в основном (исключения, в перекиси водорода его степень окисления (-1), со фтором кислород (+1,+2).
Фтор в соединениях имеет постоянную степень окисления (-1).
Углерод имеет степень окисления (-4), например, в метане CH4 и карбидах AI3C4, в оксидах (+2 и+4), в кислоте и карбонатах (+4)
Азот (-3) в ионе аммония NH4, аммиаке NH3, в нитридах, а в др соединениях азот имеет (от+1 до +5). Степень окисления элемента, стоящего на втором месте в соединении чаще всего отрицательна (-), например, в сульфиде меди (II) сера (-2) CuS-2, фосфор в Р4О6 степень (+3), а кислород (-2), в соединениях Ca(CIO)2, HCIO степень хлора+1.
Сумма всех степеней окисления в сложном веществе равна нулю. Степень окисления простого вещества равна нулю.
Задание 5. Оценивается в 1 балл.
Виды химических связей
Ковалентная неполярная (одинаковые неметаллы): молекулы водорода Н2, кислорода О2, азота N2, хлора CI2, фтора F2, бром Br2, кремний Si , белый фосфор Р4, ромбическая сера S8, углерод C20
Ковалентная полярная (смесь разных неметаллов): это кислотные оксиды, несолеобразующие оксиды, кислоты. Например, фтороводород- HF, бромоводород- HBr, иодоводород-HI, сероводород-H2S, оксид серы (IV) SO2, хлорид фосфора (III) PCI3, вода, оксид кремния SiO2, аммиак NH3, оксид фосфора P2O5, H2SO4 серная кислота, углекислый газ СО2
Ионная (метал+ неметалл и в солях аммония): это основные и амфотерные оксиды, основания, соли. Например, сульфид калия K2S, оксид лития Li2O, оксид натрия Na2O, фторид калия KF, фторид магния MgF2, фторид натрия NaF, бромид кальция CaBr2, бромид натрия NaBr, хлорид калия KCL, оксид бария ВаО, сульфид натрия Na2S, сульфид калия K2S, поваренная соль (хлорид натрия) NaCI, хлорид бария BaCI2, хлорид аммония NH4CI
Металлическая (металлы): например, цинк Zn, магний Mg, медь Cu, бериллий Ве, свинец Pb, барий Ba, кальций Ca, натрий Na
Задание 6. Оценивается в 1 балл.
Выберите два верных, либо не верных утверждения из 5 предложенных. Строение атома. Электроотрицательность. Высшие оксиды, летучие водородные соединения.
Изменение свойств веществ по таблице Менделеева
в одном периоде слева на право,
например, бор → углерод → азот
-уменьшаются радиусы атомов
-увеличивается валентность элемента в высшем оксиде
-уменьшается валентность элемента в летучем водородном соединении
(степень окисления в соединении с водородом)
-значение электроотрицательности элемента возрастает
-увеличивается число электронов во внешнем электронном слое
-усиливаются неметаллические свойства простых веществ
-уменьшается металлический характер простого вещества
-усиление окислительной способности атомов
-усиливаются кислотные свойства высших оксидов
в одной группе сверху вниз,
например, азот →фосфор→ мышьяк→ сурьма
-увеличивается радиус атомов
-усиливаются металлические свойства простых веществ
-усиление восстановительной способности
-усиливается основный характер высшего оксида
-увеличивается число заполняемых электронных слоёв
-значения электроотрицательности атомов уменьшается
-уменьшение окислительной способности
Задания 7. Оценивается в 1 балл. Классификация веществ.
Задание 8. Оценивается в 1 балл. Химические свойства простых веществ, оксидов.
Задание 9, 10 — оценивается в 2 балла. Химические свойства веществ.
Простое вещество (состоит их одного типа химического элемента):
неметаллы-водород H2, бор В, алмаз С, графит С, кремний Si, красный фосфор Р, белый фосфор Р4 ромбическая сера S8, селен Se, озон О3, кислород О2, фтор F2, бром Br2, йод I2, азот N2, инертные газы одноатомны (гелий, неон, аргон, криптон, ксенон, радон)
металлы-например, литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, кальций Ca, барий Ba, магний Mg алюминий Al, цинк Zn, свинец Pb, железо Fe.
Сложное вещество (два и более химических элементов): оксиды, основания, кислоты, соли, органические вещества, например метан СН4, аммиак, сода, угарный газ, медный купорос, вода, гипс, хлороводород. Несолеобразующие оксиды: СО, NO, N2O, SiO (не реагируют с водой, не активны)
Кислотные оксиды: (состоят из элемента в степени окисления +4 и выше и кислорода), CL2O7— оксид хлора (VII), SO3— оксид серы (VI), N2O5 , NO2-оксид азота (IV) CrO3 и Mn2O7, P2O5-оксид фосфора (V), оксид мышьяка As2O3, оксид углерода (IV) CO2, оксид кремния SiO2. С водой образуют кислоту, кроме SiO2 (речной песок, глина), который с водой не реагирует, не растворяется. Реагируют с основными и амфотерными оксидами, с щелочами, с солями.
Основные оксиды: (Металл и кислород), например, Na2O-оксид натрия, К2О, Li2O, MgO-оксид магния, СаО-оксид кальция, CuO, FeO-оксид железа (II), оксид бария ВаО. С водой дают основание. Реагируют с кислотными и амфотерными оксидами, с кислотами.
Амфотерные оксиды: оксиды некоторых металлов, например, оксид бериллия BeO, оксид хрома (III) Cr2O3, оксид цинка ZnO, оксид алюминия Al2O3, оксид железа (III) Fe2O3. Реагируют с кислотными и основными оксидами, с кислотами и щелочами.
Основания: щелочи (растворимые в воде основания): КОН–гидроксид калия, гидроксид натрия NaOH, гидроксид лития LiOH, гидроксид кальция Ca(OH)2, Ba(OH)2-гидроксид бария, гидроксид стронция Sr(OH)2. Реагируют с кислотными и амфотерными оксидами, с кислотами, с солями. При нагревании не разлагаются.
Нерастворимые основания: Сr(OH)2–гидроксид хрома (II), Fe(OH)2-гидроксид железа (II), Cu(OH)2— гидроксид меди (II). Не активны, реагируют только с кислотами. При нагревании разлагаются на оксид и воду.
Амфотерные гидроксиды: Zn(OH)2 гидроксид цинка, Be(OH)2— гидроксид бериллия, AI(OH)3— гидроксид алюминия, Fe(OH)3-гидроксид железа (III), Cr(OH)3-гидроксид хрома (III). Реагируют с кислотными и основными оксидами, с кислотами и щелочами.
Кислоты (сила кислот в ряду уменьшается): HCLO4— хлорная кислота, H2SO4— серная кислота, HNO3-азотная кислота, HCl –соляная кислота, H3PO4-фосфорная (трехосновная кислородсодержащая), H2SO3-сернистая кислота, HNO2-азотистая кислота, H2CO3— угольная кислота, H2S –сероводородная кислота, H2SiO3— кремневая кислота. Реагируют с основными и амфотерными оксидами, с основаниями, с солями, если образуется газ, осадок.
Соли средние металл и кислотный остаток, Fe2(SO4)3 –cульфат железа (III), Na2SO3— сульфит натрия, KNO3-нитрат натрия, Сa3(PO4)2 –фосфат кальция, CaCO3 –карбонат кальция (мел, мрамор, известняк), Na2SiO3–силикат натрия, AgCI –хлорид серебра, AgBr-бромид серебра, MgI2-иодид магния, CuS –сульфид меди (II). Реагируют с кислотными оксидами, с кислотами, с солями, если образуется осадок. Соли кислые KHCO3 – гидрокарбонат калия, КH2PO4 –дигидроортофосфат калия. Соли основные (CuOH)2CO3 -гидроксокарбонат меди (II)
Химические свойства простых веществ: металлов и неметаллов. Зависит от активности металла и неметалла. Реагируют с кислородом (кроме инертных газов, не активных металлов – платина, золото. С водой активные при комнатной температуре, не активные при нагревании или не реагируют. Металлы реагируют с неметаллами, с кислотами (зависит от активности), с солями, если металл более активен, чем металл внутри соли. Примеры. Кальций реагирует с соляной кислотой и хлором. Железо реагирует с CuSO4 и O2. И магний, и натрий при комнатной температуре энергично реагируют с соляной кислотой. И цинк, и кальций при комнатной температуре реагируют с бромом. И кальций, и белый фосфор при комнатной температуре реагируют с кислородом. И железо, и цинк при комнатной температуре реагируют: с сульфатом меди (II). Цинк при комнатной температуре вступает в реакцию с каждым из двух веществ: соляная кислота и нитрат серебра. Водород не реагирует с: гидроксидом натрия, Водород реагирует: оксид меди (II) и хлор. Сера реагирует с каждым из двух веществ: водород и ртуть
химические свойства оксидов. Свойства зависят от типа оксида. Основные оксиды реагируют с кислотными оксидами, кислотами, водой (оксиды металлов 1 и 2 группы главной подгруппы таблицы Менделеева. Например, химическая реакция возможна между: оксидом кальция и соляной кислотой, оксидом бария и водой, оксидом натрия и оксидом серы(IV), оксидом углерода(IV) и оксидом кальция. Кислотные оксиды реагируют с основными оксидами, с водой (кроме оксида кремния), с основаниями, с солями. Амфотерные оксиды реагируют и с кислотами, и с основаниями.
химические свойства оснований и кислот. Щелочи реагируют с кислотными оксидами, с кислотами, с солями, если выделиться осадок. Нерастворимые основания только с кислотами. Кислоты реагируют с металлами (см ряд металлов), с основными и амфотерными оксидами, с основаниями, с солями (если выделиться осадок). Например, осадок гидроксида магния растворится при взаимодействии с раствором: соляной кислоты. Кремниевая кислота реагирует с гидроксидом натрия. И с гидроксидом калия, и с серной кислотой реагирует: амфотерные соединения (гидроксид алюминия, оксид цинка). В реакцию с гидроксидом бария вступает: оксид серы(VI)
химические свойства солей. Соли реагируют с щелочами, кислотами, если выделиться осадок. Галогены, чем выше в таблице Менделеева, тем сильнее и могут вытеснить более слабый галоген из их солей. Более сильный металл (стоит левее в ряду активности металлов) вытеснит более слабый и его соли. Соль реагирует с другой солью, если исходные соли были растворимы, а в продукте реакции образовался осадок (не растворимая соль)
Задания 11 ( 1 балл), 12 задание (2 балла). Признаки химических реакций. Классификация реакций
Физическое явление (изменяется лишь агрегатное состояние, нового вещества нет), например, засахаривание варенья, деформация пластмассы, плавление парафина, перегонка нефти.
Химическое явление— появляется признак: газ, запах, изменяется цвет, образуется осадок или наоборот он растворяется, выделяется тепло, либо поглощается, иногда свет, звук, образуется новое вещество. Реакция, протекающая без изменения степени окисления- если все вещества сложные, степень окисления у веществ не изменяется. Если в реакции присутствует хотя бы одно простое вещество, то это окислительно-восстановительная реакция, так как при этом меняется степень окисления- у простого вещества степень окисления ноль, а в соединении он его изменяет. Восстановитель степень окисления повышает, а окислитель понижает. Эндотермическая реакция-энергия требуется–Q (реакции разложения). Экзотермическая + Q (энергия выделяется)
|
||||||||||||||
|
||||||||||||||
|
Реакция нейтрализации происходят между кислотой и щелочью: например, KOH и HNO3 Газ выделяется при взаимодействии: солей аммония и щелочи, например, NH4Cl и NaOH (газ аммиак), карбонатов и кислот (углекислый газ), сульфитов и кислот (сернистый газ), металла и кислоты (водород и др газы) |
Задание 13. Оценивается в 1 балл. ЭД, электролиты и не электролиты, катионы (+), анионы (-). Электрический ток проводят (электролиты) Лампочка прибора для испытания электропроводности загорится при погружении электродов в электролиты. Электролиты- растворимые соли, щелочи, кислоты сильные (серная, соляная, азотная и др). Электрический ток проводят: расплав сульфата натрия, раствор поваренной соли, HNO3. Электрический ток не проводят (не электролиты), лампочка прибора для испытания электропроводности не загорится при погружении электродов в электролиты: органические вещества-метан CH4 , этан C2H6 этилен C2H4, бутан, графит, алмаз, сахар, раствор сахарозы, глюкоза, спирты-метанол CH3OH, этанол C2H5OH , глицерин, парафин, газы, оксиды ZnO, SiO2, оксид азота(II), CO, CO2 неметаллы-например, расплав серы, фосфора. Распад на ионы -электролитическая диссоциация (катионы+ и анионы -)
Задание 14. Оценивается в 1 балл. Ионные уравнения, условия их протекания, если образуется: газ, осадок, вода
Задание 15. Оценивается в 1 балл. Окислительно-восстановительные реакции. Окислитель. Восстановитель.
Задания 16, 19. Оценивается в 1 балл. Чистые вещества и смеси. Техника безопасности. Химия и жизнь.
Чистые вещества имеют постоянный состав, формулу, температуру кипения (это индивидуальные вещества): пример, аргон, питьевая сода, озон, сероводород, серебро, алмаз, дистиллированная вода, алюминий.
Смеси однородные (нельзя обнаружить невооруженным глазом и лупой): раствор поваренной соли, раствор сахара в воде, сталь, столовый уксус, газированная вода, минеральная вода, кровь, напиток какао, сливочное масло, сметана, раствор йода в этиловом спирте для обработки ран, морская вода, молоко, кефир, майонез, нашатырный спирт, 3% перекись водорода, воздух, нефть, вода из ручья, оконное стекло, природный газ, духи, раствор гидроксида кальция в воде, процеженный чай, прозрачный яблоневый сок. Смеси неоднородные: смесь порошка серы и железа, гранит, растительное масло и вода, мел и вода, задымленный воздух, дым, мясной бульон. Смесь поваренной соли с речным песком можно разделить с помощью добавлении воды, последующего фильтрования и выпаривания. Смесь серы и древесные опилки путем растворения в воде нельзя разделить.
Физические способы разделения смесей: перегонка (дистилляция): воду и спирт (этанол), бензин на компоненты, (воздух нельзя разделить перегонкой). При дистилляции фильтровальная бумага не нужна, так вещество нагревают, переводят в пар, охлаждают и конденсируют, выпаривание: очищаем морскую воду от солей, сахар из водного раствора, фильтрование: твердое нерастворимое примесь и воду, вода и порошок мела, а растворимые вещества и другие однородные смеси удалить фильтрованием не возможно, например соли из водопроводной воды, для разделения осадка от раствора, речной песок и сахар (но потом выпаривать), речной песок служит фильтром при разделении древесных стружек от воды, для очистки воды от тины, кислород и углекислый газ фильтрованием не разделишь, кипячением воды –твердые примеси не разделишь. Воду и сахар фильтрованием тоже не разделишь. Для ускорения процесса фильтрования скошенный конец воронки следует прижать к стенке химического стакана, магнит- железные опилки (так как железо притягивается к магниту), а медь, алюминий не притягивается, делительная воронка (деление 2-х несмешивающихся жидкостей): смесь воды и бензина, воду и нефть, растительное масло и вода, отстаивание –древесные и стальные опилки (а песок и железные опилки так не разделить).
В школьной лаборатории есть опасные вещества, поэтому их нельзя смешивать друг с другом в любом порядке.
СО—оксид углерода (II) угарный газ сильный яд в замкнутом пространстве, угрожающий фактор для здоровья (отравление). Озоновый слой в стратосфере не вреден для человека, хотя озон сам по себе ядовит. В стратосфере озоновый слой защищает Землю от у/ф лучей солнца.
Производство цемента и др строительных материалов загрязняют окружающую среду. Разлившаяся на поверхности водоёмов нефть вредит живым организмам водоёмов.
Оксиды азота и сернистый газ (отходы производства серной и азотной кислоты), в атмосфере угрожают здоровью человека. Загрязнение воздуха оксидами серы (сернистого газа) вызывает образование кислотных дождей. Продукты полного сгорания природного газа–углекислый газ и пары воды–не наносят непосредственного ущерба окружающей среде. Некоторые выхлопные газы авто негативно сказываются на состояние атмосферы. В двигателе внутреннего сгорания идет реакция горения. Самый опасный продукт сгорания автомобильного топлива–не CO2 (углекислый газ), а угарный газ СО и оксиды азота. Увеличение количества углекислого газа в атмосфере приводит к «парниковому эффекту». Углекислый газ не ядовит, поэтому его повышенное содержание в атмосфере не влияет на жизнь человека.
Реакция «свёртывания» молока используется для изготовления творога и сыра. В основе выплавки чугуна и стали лежат окислительно-восстановительные реакции. Разбитый градусник и вытекающую ртуть нельзя выбрасывать в мусорное ведро. Неорганические кислоты в промышленных стоках отрицательно влияют на рыб. Ионы тяжелых металлов, содержащихся в овощах, выращенных у дороги вредят здоровью человека, так же избыток удобрений для овощей, вредны бензин, содержащий свинец, отходы свинцовой руды вредят здоровью человека. Краска со свинцом на игрушках вредна. Готовить растворы кислот в алюминиевой посуде не рекомендуется. При растворении твёрдой щелочи в воде для перемешивания раствора нельзя использовать алюминиевую ложечку.
Щелочь можно промыть с кожи водой и лимонной кислотой, а кислоту промываем водой и питьевой содой. Пролитые кислоты или щёлочи необходимо засыпать чистым песком
Работаем с горючими жидкостями в дали от источников огня, (например, ацетон нет необходимости хранить в холодильнике)
Хлор в лаборатории всегда получают в вытяжном шкафу, так как он опасен, имеет резкий запах, при работе с хлорсодержащими дезинфицирующими веществами нельзя работать при плотно закрытой двери. Не все газы получают в вытяжном шкафу, например, кислород, водород, углекислый газ. В лаборатории на вкус ничего нельзя пробовать (особенно кислоты и щелочи). Принимать пищу в лаборатории нельзя!
Дезинфицирующие средства, например, «Доместос» опасны для человека и животных, отходы от моющих средств нельзя выливать в природные водоемы. Растворители и моющие средства и др бытовую химию храним в не доступном для детей месте, отдельно от пищевых продуктов, соблюдаем инструкцию при работе с ними. Аэрозоли как средство борьбы против насекомых опасны для детей и животных, будьте осторожны, нельзя распылять в близи огня. Со стиральным порошком посуду мыть нельзя. Жир не удалиться водопроводной водой, а моющими средствами, имеющими щелочную среду. Чем больше щелочи в составе моющего средства, тем она опаснее для ткани
При работе с растворами солей не всегда нужны перчатки, например, при работе с безопасными веществами перчатки и очки не нужны при растворении соды в воде, при работе с 3% пероксидом водорода. При работе с бытовой химией, (с препаратами для ванн и раковин) содержащей щелочь и кислоту нужны резиновые перчатки!
витамин С в неограниченном количестве нельзя применять! Проверяем срок годности и правильно храним витамины, жиры. При квашении капусты идет реакция брожения
запрещается заглядывать сверху в посуду с кипящим раствором, при определении запаха подносить к носу и глубоко вдыхать нельзя. При ознакомлении с запахом вещества необходимо держать склянку на расстоянии в 15–20 см от лица и направлять воздух от отверстия склянки на себя легкими движениями руки. Колбу герметично при нагревании жидкости не закрываем
столовый уксус не хранят вместе с бытовой химией
при приготовлении раствора серной кислоты сначала берем воду (безопасное вещество), а потом наливаем кислоту
кисломолочные продукты хранят при определенной температуре, даже, если они герметично закрыты.
раствор медного купороса для опрыскивания садовых деревьев нельзя хранить в оцинкованной посуде (цинк активнее меди и вытеснит его)
воспламенившийся бензин тушить водой нельзя
полиэтиленовые пакеты долго разрушаются, угроза засорения для окружающей среды
склянки без надписи для опытов использовать нельзя
опыты с горючими и едкими веществами необходимо проводить в защитных очках
застывшую масляную краску перед использованием нельзя греть на открытом огне (огнеопасное вещество), при ремонте с использованием органических растворителей в помещении окна открываем! Хранить органические растворители в дали от нагревательных приборов.
все опыты должны быть записаны в лабораторный журнал
Аэрометр – для измерения плотности воздуха
Ареометр-для измерения плотности жидких веществ (растворов)
Делительная воронка-устройство для разделения несмешивающихся жидкостей
Фарфоровая чашечка и ступка для измельчения твердых веществ (а не для выпаривания растворов!)
Выпарительная чашка для выпаривания и получения твердого вещества из раствора (соли из воды)
Мерный цилиндр— для измерения объёма жидкости (а не газов!)
Пробирка с газоотводной трубкой для собирания газа, а не для отвода теплоты.
При пересыпании медного купороса из склянки в пробирку нужен шпатель— ложечка (а не воронка для жидкостей), не все твердые вещества руками в лаборатории брать можно
Спиртовка не служит для долгого хранения спирта, пробирку нагреваем постепенно и под углом, а не вертикально, тушат огонь колпачком, а не задуванием. Для более эффективного нагревания пробирки с жидкостью её вносят в центральную часть пламени спиртовки. Не допускается поджигать спиртовку от другой горящей спиртовки.
Определить наличие в сосуде углекислого газа можно с помощью известковой воды (помутнение). Аммиак в лаборатории получают действием щелочей на соли аммония
При пропускании газа через трубку с раскалённой медью цвет порошка изменился с красного на чёрный. О каком газе идёт речь? (это водород). Кислород можно отличить от углекислого газа с помощью тлеющей лучинки (в кислороде он горит).
Азот в лаборатории получают разложением нитрита аммония при нагревании. В лаборатории кислород можно получить: каталитическим разложением пероксида водорода, разложением перманганата калия при нагревании. В лаборатории углекислый газ получают действием соляной кислоты на известняк.
Не растворимые в воде газы можно получить методом вытеснения воды. Вода вытесняется из перевернутой пробирки, так как не растворимый газ выталкивает его.
Задание 17. Оценивается в 2 балла.
Качественные реакции – это реакции, позволяющие определить присутствие в растворе (или иной реакционной среде) определённых ионов (или других частиц).
Качественные реакции сопровождаются признаками: изменение цвета, выделение газа, образование осадка, изменение запаха, выделение или поглощение теплоты, растворение осадка также является признаком химической реакции.
Качественные реакции на изученные катионы и анионы (ионный обмен)
|
Катионы |
Анионы |
Признаки реакций. |
|
H+ |
SO32- |
выделение бесцветного газа с едким запахом |
|
H+ |
CO32- |
выделение бесцветного газа |
|
H+ |
SiO32 |
образование бесцветного студенистого осадка |
|
NH4+ |
OH— |
при нагревании запах аммиака |
|
Zn2+ |
OH— |
образование белого студенистого осадка |
|
Cu2+ |
OH— |
образование голубого студенистого осадка |
|
Al3+ |
OH— |
образование белого студенистого осадка |
|
Fe2+ |
OH— |
образование зеленого студенистого осадка |
|
Ag+ |
Cl— |
образование белого творожистого осадка |
|
Ag+ |
Br— |
образование светло-желтого творожистого осадка |
|
Ag+ |
I— |
образование желтого творожистого осадка |
|
Ca2+ |
CO32-(CO2) |
образование белого осадка (помутнение) |
|
Ba2+ |
SO42- |
образование белого плотного осадка |
Изменение цвета растворов индикаторов
|
Растворы кислот |
Лакмус Метилоранж |
изменение цвета на красный изменение цвета на розовый |
|
Растворы оснований. |
Лакмус Метилоранж Фенолфталеин |
изменение цвета на синий изменение цвета на желтый изменение цвета на малиновый. |
Признаки химических реакций (окислительно-восстановительные реакции)
|
Реагенты |
Признаки |
|
|
Na(или друг металл) |
H2O |
выделение бесцветного газа, сгорающего с хлопком |
|
Zn |
HCl |
выделение бесцветного газа, сгорающего с хлопком |
|
Cu |
H2SO4 (конц) |
выделение бесцветного газа, с едким запахом |
|
Cu |
HNO3 (конц) |
выделение бурого газа |
|
CuO |
H2 |
изменение цвета с черного на красный |
|
H2O2 |
MnO2 (катализатор) |
Выделение газа поддерживающего горение, выделение теплоты |
Задание 18. Оценивается в 1 балл.
Вычисление массовой доли элемента по таблице Менделеева.
Чтобы найти массовую долю хим элемента, делим массу атома (умножив на количество атомов в данной формуле вещества) на массу всей молекулы. Если подсчёт в процентах, то умножаем на 100%. Атомные массы элементов округляем до целого, кроме хлора, его атомная масса 35,5
Примеры подсчитанных молекулярных масс веществ, которые встречаются в заданиях.
Оксид хлора (VII) CL2O7=183, оксид бора B2O3=59, фосфорная кислота H3PO4 =98, азотная кислота HNO3 =63, бромид бария BaBr2=297. Нитрат кальция Ca(NO3)2=164, нитрат аммония NH4NO3=80, нитрат бария Ba(NO3)2=261, нитрат цинка Zn(NO3)2=189, нитрат железа(II) Fe(NO3)2=180, нитрат железа(III) Fe(NO3)3=242, нитрат меди(II) Cu(NO3)2=188, нитрат алюминия AL(NO3)3=213, нитрат натрия NaNO3=85, нитрат калия KNO3=101, нитрат магния Mg(NO3)2=148, гидроксид лития LiOH=24, гидроксид натрия NaOH=40, гидроксид железа(II) Fe(OH)2=90, гидроксид железа(III) Fe(OH)3=107
Задания с развернутым ответом. Практическая часть. Проверяет эксперт.
Задание 20. Окислительно-восстановительная реакция. Окислитель (понижает степень окисления) и восстановитель (повышает). 3 балла
Задание 21. Химические реакции по схеме (цепочке превращений). 4 балла.
Задание 22. Задача. 3 балла
Задание 23. Экспериментальная мысленная задача. 4 балла
Задание 24. Практическое выполнение задания 23 в виде двух реакций (в отдельных пробирках). Оценивается техника выполнения, техника безопасности. 2 балла
180 минут, максимальный балл 40
0-9- «2»
10-20-«3»
21-30-«4»
31-40-«5»
Уважаемый посетитель!
Если у вас есть вопрос, предложение или жалоба, пожалуйста, заполните короткую форму и изложите суть обращения в текстовом поле ниже. Мы обязательно с ним ознакомимся и в 30-дневный срок ответим на указанный вами адрес электронной почты
Статус Абитуриент Студент Родитель Соискатель Сотрудник Другое
Филиал Абакан Актобе Алагир Алматы Алушта Анапа Ангарск Архангельск Армавир Асбест Астана Астрахань Атырау Баку Балхаш Барановичи Барнаул Белая Калитва Белгород Бельцы Берлин Бишкек Благовещенск Бобров Бобруйск Борисов Боровичи Бронницы Брянск Бузулук Чехов Челябинск Череповец Черкесск Дамаск Дербент Димитровград Дмитров Долгопрудный Домодедово Дубай Дубна Душанбе Екатеринбург Электросталь Елец Элиста Ереван Евпатория Гана Гомель Гродно Грозный Хабаровск Ханты-Мансийск Хива Худжанд Иркутск Истра Иваново Ижевск Калининград Карабулак Караганда Каракол Кашира Казань Кемерово Киев Кинешма Киров Кизляр Королев Кострома Красноармейск Краснодар Красногорск Красноярск Краснознаменск Курган Курск Кызыл Липецк Лобня Магадан Махачкала Майкоп Минеральные Воды Минск Могилев Москва Моздок Мозырь Мурманск Набережные Челны Нальчик Наро-Фоминск Нижневартовск Нижний Новгород Нижний Тагил Ногинск Норильск Новокузнецк Новосибирск Новоуральск Ноябрьск Обнинск Одинцово Омск Орехово-Зуево Орел Оренбург Ош Озёры Павлодар Пенза Пермь Петропавловск Подольск Полоцк Псков Пушкино Пятигорск Радужный Ростов-на-Дону Рязань Рыбинск Ржев Сальск Самара Самарканд Санкт-Петербург Саратов Сергиев Посад Серпухов Севастополь Северодвинск Щербинка Шымкент Слоним Смоленск Солигорск Солнечногорск Ставрополь Сургут Светлогорск Сыктывкар Сызрань Тамбов Ташкент Тбилиси Терек Тихорецк Тобольск Тольятти Томск Троицк Тула Тверь Тюмень Уфа Ухта Улан-Удэ Ульяновск Ургенч Усть-Каменогорск Вёшенская Видное Владимир Владивосток Волгодонск Волгоград Волжск Воркута Воронеж Якутск Ярославль Юдино Жлобин Жуковский Златоуст Зубова Поляна Звенигород
Тип обращения Вопрос Предложение Благодарность Жалоба
Тема обращения Поступление Трудоустройство Обучение Оплата Кадровый резерв Внеучебная деятельность Работа автоматических сервисов университета Другое
* Все поля обязательны для заполнения
Я даю согласие на обработку персональных данных, согласен на получение информационных рассылок от Университета «Синергия» и соглашаюсь c политикой конфиденциальности
Подготовка с нуля к ОГЭ по химии
Начинать подготовку к экзамену нужно с изучения теоретической части, закрепляя пройденный материал решением практических заданий. В экзамен по химии входят следующие теоретические разделы:
1. Строение атома. Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
2. Химические свойства простых веществ: металлов и неметаллов.
3. Чистые вещества и смеси. Разделение смесей и очистка веществ.
4. Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
5. Основные классы неорганических веществ и их химические свойства.
6. Химическая реакция. Классификация химических реакций по различным признакам.
7. Электролитическая диссоциация кислот, щелочей и солей (средних).
8. Реакции ионного обмена и условия их осуществления. Качественные реакции на ионы в растворе, на газообразные вещества.
9. Окислительно-восстановительные процессы.
10. Правила безопасной работы в школьной лаборатории. Химическое загрязнение окружающей среды и его последствия.
11. Первоначальные сведения об органических веществах: предельных и непредельных углеводородах, белках, жирах, углеводах.
12. Решение расчетных задач на вычисление количества вещества, массы или объема вещества по количеству вещества, массе или объему одного из реагентов или продуктов реакции, вычисление массовой доли химического элемента в веществе.
Составьте план подготовки и начинайте готовиться, не откладывая на последний месяц:
— задайте себе режим подготовки, например, ежедневно по 1,5 часа;
— изучайте теоретический материал по учебнику;
— отрабатывайте теорию практическими заданиями демонстрационных тестов.
Например, тема «Строение атома. Периодический закон и Периодическая система химических элементов Д.И. Менделеева». При изучении раздела делайте краткие записи. Это поможет запомнить теоретический материал. Затем приступайте к решению заданий ( №1,2,16). Когда добьётесь устойчивого верного решения, переходите к следующему разделу.
Строгое выполнение плана обязательно. Времени на подготовку совсем не так много!
Автор статьи Александра Городенская
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Подготовка с нуля к ОГЭ по химии» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
09.03.2023