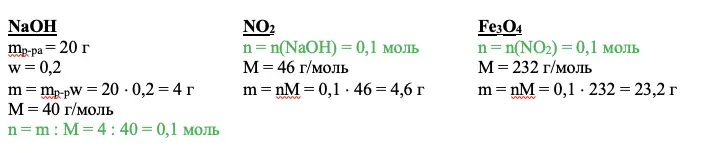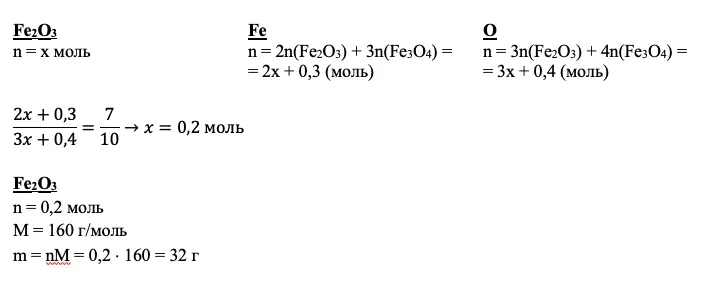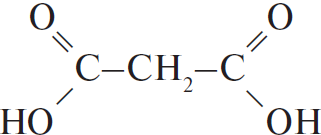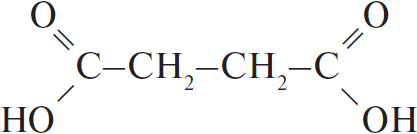5 апреля 2017
В закладки
Обсудить
Жалоба
Полезная информация по оформлению заданий с развернутым ответом и критерии оценивания. Памятка основана на демоверсии текущего года.
В задачах 33 и 34 единого правила оформления нет, но решение должно быть записано четко и логично, а все величины соотноситься с веществами.
Источник: vk.com/chem4you
himiya-30-34.pdf
Ни для кого не секрет, что задача 33 (она же бывшая задача 34) в ЕГЭ по химии — самое сложное задание, а судя по статистике (только 8,3% выпускников справляются с ним), она еще и практически невыполнимая. Поэтому значительное число выпускников даже не читают условие этой задачи. А зря. Если вы пришли на экзамен по химии, то уж точно сможете записать несколько уравнений, ведь так?
Задача 33 по химии: суть и критерии оценивания
Задание № 33 в ЕГЭ по химии — это расчетная задача высокого уровня сложности. Чтобы успешно решить ее, вам необходимо знать химические свойства веществ, уметь устанавливать логические связи между реакциями, применять расчетные формулы для нахождения количества вещества, массы и объема, массовой доли вещества в смеси.
Для получения максимально возможных 4 баллов за задачу 33 вам предстоит:
- записать все уравнения реакций, описанных в тексте (1 балл);
- рассчитать количества вещества всех известных и искомых веществ (1 балл);
- провести анализ и рассчитать искомые величины (1 балл);
- дать правильный ответ и безошибочно оформить решение (1 балл; снимается за отсутствие размерных величин — больше трех, также за математические ошибки)
Но слова в сторону, нам нужна успешная пошаговая стратегия: что делать, чтобы не получить за этот номер 0?
ЕГЭ по химии — в принципе достаточно сложный экзамен. Чтобы получить за него высокий балл, нужно хорошо постараться. Так, необходимо хорошо знать теорию и формулы, уметь выводить уравнения без ошибок, понимать, как правильно читать задания (в них могут быть ловушки!) и оформлять ответы по критериям. И все это — за ограниченный период времени.
Чтобы не стрессовать на экзамене и показать лучший результат, записывайтесь ко мне на курсы подготовки к ЕГЭ по химии. Мы изучим только то, что гарантированно пригодится вам на экзамене: ничего лишнего, только актуальные знания. А пробные экзамены, которые мы обязательно проводим, помогут понять, что ЕГЭ — совсем не такое страшное. Приходите к нам — за знаниями и спокойствием!
Пошаговый разбор реального задания 33
Уровень «Новичок»
Вы выбрали химию для поступления и готовилист к ЕГЭ минимум год. Вам абсолютно под силу записать уравнения реакций, описанных в тексте. Чаще всего здесь встречаются реакции обмена, замещения и разложения, ОВР, электролиз и совместный гидролиз. Правильно записанные реакции с расставленными коэффициентами дают 1 первичный балл за 33 задачу в ЕГЭ по химии.
ШАГ 1. Запишите все уравнения реакций, о которых идет речь в тексте
Если возможны вариации одной и той же реакции, рассмотрите их на черновике (например, получение средних/кислых солей, образование амфотерного гидроксида/ комплексной соли и т.п.). Какую реакцию оставить, вы поймете после получения первых результатов расчета.
Совет: повторите перед экзаменом тривиальные названия. Например, если вы не знаете, что такое «железная окалина», то ни записать реакцию, ни решить данную задачу не удастся 🙃
Смесь железной окалины и оксида железа III растворяют в азотной концентрированной кислоте. Запишем их по очереди. Железная окалина содержит железо в степени окисления +2, отсюда и протекание окислительно-восстановительной реакции: железо повышает степень окисления до +3, а азот изменяет свою степень окисления с +5 до +4. Вторая реакция представляет собой классическую реакцию обмена:
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Образовавший газ (это NO2, полученный в первой реакции) взаимодействует с гидроксидом натрия:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
ИТОГО: +1 балл
С одним пунктом вы справились. Далее запишите «дано». Баллов за эту запись вам не добавят, но при этом вы сможете увидеть все известные величины и помнить, что необходимо найти.
Дано:
N(Fe) : N(O) = 7 : 10
mp-p(HNO3) = 500 г
mp-p(NaOH) = 20 г
w(NaOH) = 20%
Найти:
w(Fe(NO3)3) — ?
Уровень «Мастер»
Вы готовы сделать больше, чем записать уравнения реакции. Вы помните основные расчетные формулы и можете найти количество вещества по заданной массе и объему.
ШАГ 2. Используйте известные числовые значения, чтобы рассчитать количества вещества всех необходимых участников реакций
Переходим к действию. Нужно найти вещество, о котором мы все знаем. В приведенном примере это гидроксид натрия. Необходимо рассчитать количество вещества. Используем для этого основные расчетные формулы:
NaOH
mp-pa = 20 г
w = 0,2
m = mp-pw = 20 × 0,2 = 4 г
М = 40 г/моль
n = m : M = 4 : 40 = 0,1 моль
Задаем себе вопрос: что нам дает это значение? Каждый ответ должен вести к следующему действию. Так, мы можем рассчитать количество оксида азота IV – NO2, а благодаря ему получим количество вещества Fe3O4.
Совет: в задаче 33 по химии рассчитывайте сразу и количество вещества, и массу любого соединения, с которым работаете. Эти массы пригодятся при нахождении итогового раствора. А если не пригодятся, не переписывайте их в чистовик.
ИТОГО: +1 балл
Уровень «Гуру»
Вас не пугает уравнение с иксом в химии. Более того, вы можете его и составить, и решить.
ШАГ 3. Продумайте, как от найденных количеств вещества дойти по цепочке до искомого соединения
Что нужно найти дополнительно, чтобы получить ответ в задаче 33 по химии? Здесь может пригодиться работа с переменными, пропорции, соотношения и даже составление системы уравнений с двумя неизвестными.
Работаем!
Мы получили количества вещества нескольких соединений. Но так и не добрались до второй реакции и Fe2O3. Кроме того, мы не использовали соотношение атомов. Если вам ничего не дано для вещества по условию, а также вам не удалось подойти к нему через промежуточные расчеты, дело за уравнением. За х всегда принимайте количество неизвестного вещества.
Для нашего примера получим:
Совет: не пытайтесь принять за х все, что не получается рассчитать. Чаще всего задача 33 по химии решается без каких-либо переменных.
ИТОГО: +1 балл
Уровень «Профессионал»
Самое сложное уже позади. Теперь вам остается грамотно довести до конца. Обычно в завершении задачи требуется рассчитать массу полученного раствора и массовую долю вещества в нем. Чтобы не допустить ошибку на последнем этапе, помним, что в раствор входят все вещества, описанные в условии задачи, за исключением веществ, участвующих в реакциях сплавления, разложения и горения. Также обязательно нужно вычесть из этой массы потери. Потерями считаем осадки, газы, выпаренную воду, непрореагировавшие металлы и их оксиды.
ШАГ 4. Внимательно прочитайте вопрос задачи и рассчитайте искомую величину
Чаще всего необходимо вычислять массовую долю вещества в растворе. Предварительно вычислите массу полученного раствора с учетом всех потерь — осадков, газов и т.п.
В приведенном примере в раствор входит смесь железной окалины и оксида железа (III) и раствор азотной кислоты. Потеря — газообразное вещество NO2 (он же бурый газ).
mp-pa = m(Fe3O4) + m(Fe2O3) + mp-p(HNO3) – m(NO2) = 23,2 + 32 + 500 – 4,6 = 550,7 г
Зная количества вещества оксидов, вычислим количество вещества и массу искомой соли, а также ее массовую долю:
ИТОГО: +1 балл
Вот вы и решили 33 задачу в ЕГЭ по химии. Сложная ли она? Безусловно. Но можно ли с ней побороться? Да! Помните, что это задание, как и любое другое из второй части, оценивают согласно критериям. Не оставляйте его совсем без решения. Вы сможете остановиться на любом этапе и при этом принести в свою копилку больше, чем 0 баллов. А в пересчете на 100-балльную шкалу это будет уже весомо!
А если хотите научиться пошагово решать и другие задания из ЕГЭ по химии, записывайтесь ко мне на курсы подготовки к экзамену. Мы разберемся во всей теории, будем тренироваться в практических заданиях и научимся оформлять ответы в полном соответствии с критериями. Не теряйте возможность получить 80+ за ЕГЭ по химии — записывайтесь.
-
Типы задач в задании 33.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Дополнение по определению структурной формулы:
-
Ответы и комментарии к задачам для самостоятельного решения.
Автор статьи — профессиональный репетитор О. В. Овчинникова.

- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки при написании требуемых уравнений реакций с участием найденного вещества.
к оглавлению ▴
Типы задач в задании 33.
- 1. Определение молекулярной формулы вещества по массовым долям химических элементов или по общей формуле вещества, а затем его структурной формулы по химическим свойствам;
- 2. Определение молекулярной формулы вещества по продуктам сгорания, а затем его структурной формулы по химическим свойствам.
Стоит отметить, что во всех подобных заданиях ЕГЭ требуется написать уравнение реакции, в котором принимает участие искомое вещество. Так что знание реакций тоже необходимо.
к оглавлению ▴
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе составасодержится
атома углерода и
атома водорода. Если взять
молекулу такого вещества, то его молекулярная масса будет равна:
а.е.м. и там содержится
а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
или
Если вещество имеет общую формулу
, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса
атомов
равна
, масса
атомов
, масса
атомов кислорода
Тогда
Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например,
— истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение, т.е. простейшая формула бензола —
.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол Бутен Уксусная кислота Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа
по газу
Относительная плотность
— это величина, которая показывает, во сколько раз газ
тяжелее газа
. Её рассчитывают как отношение молярных масс газов
и
:
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа
по водороду:
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за
г/моль (исходя из примерного усреднённого состава).
Поэтому: - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса
л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
Если взять
моль газа, то тогда:
,
а молярную массу газа можно найти, умножая плотность на молярный объём.
- Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы — Алкены Алкины Диены — Гомологи бензола Предельные одноатомные спирты Многоатомные спирты Предельные альдегиды Кетоны Фенолы Предельные карбоновые кислоты Сложные эфиры Амины Аминокислоты (предельные одноосновные)
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
-
Пример 1.
Определить формулу вещества, если оно содержити
и имеет относительную плотность по воздуху, равную
.
Решение примера 1.
- Пусть масса вещества равна
г. Тогда масса
будет равна
г, а масса
г.
- Найдём количество вещества каждого атома:
моль,
моль.
- Определяем мольное соотношение атомов
и
:
(сократим оба числа на меньшее)
(домножим на
)
Таким образом, простейшая формула
. Однако вещества с такой формулой не существует. Для нахождения молекулярной формулы нам потребуется домножать простейшую формулу на небольшие числа: 2, 3 и т. п. Например при домножении эмпирической формулы на 2 мы получаем алкан, имеющий в своём составе 8 атомов углерода:
.
Чтобы проверить, правильна ли найденная нами формула, необходимо использовать дополнительные данные, которые всегда указаны в задаче. Это могут быть либо химические свойства вещества, либо информация, позволяющая вычислить его молярную массу. В данном случае дана относительная плотность соединения по воздуху. - По относительной плотности рассчитаем молярную массу:
г/моль.
Молярная масса, соответствующая простейшей формуле
г/моль, это в
раза меньше истинно молярной массы.
Значит, истинная формула
.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу ( г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
т.е. число атомов
т.е число атомов
Формула вещества .
-
Пример 2.
Определить формулу алкина с плотностьюг/л при нормальных условиях.
Решение примера 2.
Общая формула алкина
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность — это масса
литра газа при нормальных условиях.
Так как моль вещества занимает объём
л, то необходимо узнать, сколько весят
л такого газа:
плотность
молярный объём
г/л
л/моль =
г/моль.
Далее, составим уравнение, связывающее молярную массу и :
Значит, алкин имеет формулу
-
Пример 3.
Определить формулу предельного альдегида, если известно, чтомолекул этого альдегида весят
г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в моль вещества.
Это число Авогадро: (молекул).
Значит, можно найти количество вещества альдегида:
моль,
и молярную массу:
г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим .
Общая формула предельного альдегида , то есть
.
-
Пример 4.
Определить формулу дихлоралкана, содержащегоуглерода.
Решение примера 4.
Общая формула дихлоралкана: , там
атома хлора и
атомов углерода.
Тогда массовая доля углерода равна:
число атомов
в молекуле
атомная масса
молекулярная масса дихлоралкана
вещество — дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось
г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) —
Тогда схема реакции сгорания выглядит так:
Нетрудно заметить, что при сгорании
моль алкана выделится
моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
моль.
- При пропускании углекислого газа через известковую воду
выпадает осадок карбоната кальция:
Масса осадка карбоната кальция —
г, молярная масса карбоната кальция
г/моль.
Значит, его количество вещества
моль.
Количество вещества углекислого газа тоже
моль.
- Количество углекислого газа в
раза больше чем алкана, значит формула алкана
.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна. При сжигании
г этого соединения образуется
л углекислого газа (н. у) и
г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов и, возможно,
. Поэтому его общую формулу можно записать как
.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду.
- Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
моль.
На одну молекулу
приходится один атом
, значит, углерода столько же моль, сколько
.
моль
моль.
В одной молекуле воды содержатся два атома
, значит количество водорода в два раза больше, чем воды.
моль.
- Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
- Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
Простейшая формула
.
- Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул
и его молярная масса
г/моль):
г/моль.
Истиная формула
, её молярная масса
.
Истинная формула
.
-
Пример 7.
Определите молекулярную формулу вещества, при сгоранииг которого образовалось
г
г воды и азот. Относительная плотность этого вещества по водороду —
. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы
и
. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения: - Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
- Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
г ,
моль.
Простейшая формула —
Истинная молярная масса
г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
-
Пример 8.
Вещества содержити
. При сгорании
г его выделилось
г
г
, а сера была полностью переведена в сульфат бария, масса которого оказалась равна
г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
моль.
моль.
моль.
моль.
моль.
моль.
- Рассчитываем предполагаемую массу кислорода в исходном веществе:
- Находим мольное соотношение элементов в веществе:
Формула вещества
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы
получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветитьг
-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов —
.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с
моль диена вступят
моль брома:
- Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
г
моль.
- Так как количество брома, вступившего в реакцию, в
раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через
:
Это пентадиен
.
-
Пример 10.
При взаимодействииг предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования
мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта —
Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой
.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
- Находим молярную массу спирта и
:
Спирт — бутанол
.
-
Пример 11.
Определить формулу сложного эфира, при гидролизег которого выделяется
г спирта и
г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
Соответственно, спирт будет иметь формулу
,
а кислота
.
Уравнение гидролиза сложного эфира:
- Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
= (масса кислоты) + (масса спирта) − (масса эфира) =
г
моль
Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:
г/моль,
г/моль.
Получим два уравнения, из которых найдём
и
:
— уксусная кислота
— этанол.
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
-
Пример 12.
Определить формулу аминокислоты, если при действии наг её избытком гидроксида натрия можно получить
г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно.
- Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что
.
Можно это сделать математически, если принять, что
.
.
Это аланин — аминопропановая кислота.
Однако на данном этапе решение задачи не заканчивается. В ней требуется установить и структурную формулу вещества. Вот пример подобного задания:
При сгорании 5,8 г органического вещества образуется 6,72 л углекислого газа и 5,4 г воды. Плотность паров этого вещества по воздуху равна 2.
Установлено, что это вещество не взаимодействует с аммиачным раствором оксида серебра, но каталитически восстанавливается водородом с образованием вторичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты и углекислого газа. На основании этих данных:
1) установите простейшую формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с водородом.
(источник: Типовые тестовые задания по химии, под редакцией Ю. Н. Медведева. 2015 г.)
В первой части задачи в результате вычислений мы находим молекулярную формулу соединения: C3H6O. Затем начинаем путём логических размышлений находить структурную формулу. Общая формула CnH2nO характерна для альдегидов и кетонов, так же возможно предположить спирт: пропен-2-ол-1 (напомним: соединение с гидроксильной группы у атома углерода, образующего двойную связь является неустойчивым). Во-первых, данное вещество не подвергается окислению аммиачным раствором оксида серебра, значит, это не альдегид. Во-вторых, данное вещество каталитически восстанавливается водородом с образованием вторичного спирта, а значит, это не спирт. Единственный оставшийся вариант – кетон, а именно – ацетон. Подтверждает это и возможность окисления соединения кислым перманганатом калия до углекислого газа и карбоновой кислоты. Написание уравнения реакции уже не должно вызвать затруднений.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна г/л. Массовая доля углерода в нем равна
. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна , массовая доля азота равна
. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна . Выведите молекулярную формулу карбоновой кислоты.
1–4. л алкадиена при н.у. имеет массу, равную
г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна . При сжигании
г этого вещества образуется
г углекислого газа (н.у.) и
г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой г в избытке кислорода получили
г азота,
л (н.у.)
и
г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится
молекул.
2–3. Углекислый газ, полученный при сгорании г углеводорода, пропустили через избыток раствора гидроксида кальция и получили
г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего и хлор, выделилось
л (н.у.) углекислого газа,
г воды,
г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось л (н.у.) углекислого газа,
г воды и
л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он г его при присоединении воды образуют
г спирта.
3–2. Для окисления г предельного альдегида до кислоты потребовалось
г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой г с избытком бромоводорода образует
г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой г с избытком калия выделилось
л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили г альдегида,
г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Дополнение по определению структурной формулы:
Д-1. Дана молекулярная формула: C2H6O. Искомое вещество газообразно при н. у., не реагирует с металлическим натрием и может быть получено дегидратацией спирта. Установите его структурную формулу.
Д-2. Дана молекулярная формула: C3H8O2. Искомое вещество реагирует с натрием, а при дегидратации под действием серной кислоты превращается в соединение, содержащее шестичленный цикл. Установите его структурную формулу.
Д-3. Дана молекулярная формула: C2H7NO. Искомое вещество представляет собой бесцветную, вязкую жидкость с запахом аммиака. Оно реагирует и с натрием, и с азотистой кислотой, причём в обоих случаях выделяется газ. Установите его структурную формулу.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1.
1–2.
1–3.
1–4.
1–5. — формиат кальция, соль муравьиной кислоты
2–1.
2–2.
2–3. (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. (не забудьте, что атомы водорода содержатся не только в воде, но и в
)
2–5.
3–1.
3–2.
3–3.
3–4.
3–5.
Д–1.
Д–2.
Д–3.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Задача 33 на ЕГЭ по химии. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.03.2023
За это задание ты можешь получить 3 балла. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 28.1%
Ответом к заданию 33 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
При полном сгорании углеводорода образовалось 8,96 л (н. у.) диоксида углерода и 5,4 г воды. Молярная масса углеводорода в 27 раз больше молярной массы водорода. При исследовании химических свойств этого вещества установлено, что оно обесцвечивает бромную воду, присоединяя атомы брома по четырем разным атомам углерода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с недостатком бромной воды (используйте структурные формулы органических веществ).
Решение
1) Находим количественный состав вещества.
Формула вещества — $C_xH_y$.
а) n(C) = n($CO_2$) = 8.96 / 22.4 = 0.4 моль
б) n(H) = 2n($H_2O$) = 2 · 5.4 / 18 = 0.6 моль
2) Определяем молекулярную формулу вещества:
а) $M_{ист.}(C_xH_y) = D(по H_2) · M(H_2)$ = 27 · 2 = 54 г/моль
б) x : y = n(C) : n(H) = 0.4 : 0.6 = 2 : 3 = 4 : 6
Вычисленная формула — $C_4H_6$.
$M_{выч.}(C_4H_6)$ = 54 г/моль
в) $M_{ист.}(C_xH_y)$ / $M_{выч.}(C_4H_6)$ = 54 / 54 = 1
Молекулярная формула исходного вещества — $C_4H_6$.
3) Структурная формула вещества — $CH_2=CH–CH=CH_2$ — бутадиен-1,3.
4) Записываем уравнение реакции вещества с бромом:
$CH_2=CH–CH=CH_2 + Br_2 → CH_2Br–CH=CH–CH_2Br$
Ответ:
Задача 2
При сгорании монобромпроизводного органического вещества массой 6,15 г образовался углекислый газ, 2,7 мл воды и бромоводород объёмом 1,12 л (н. у.). Известно, что данное вещество было получено при взаимодействии органического вещества с бромом при освещении.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу монобромпроизводного органического вещества;
- составьте структурную формулу этого органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции этого вещества с водным раствором гидроксида натрия (используйте структурные формулы органических веществ).
Решение
Допустим, что в веществе не содержится кислород, т. е. формула — $C_xH_yBr$.
1) Находим количественный состав образца:
а) n(Br) = n(H) = n(HBr) = 1.12 / 22.4 = 0.05 моль
m(Br) = 0.05 · 80 = 4 г
б) m($H_2O$) = 2.7 · 1 = 2.7 г; n(H) = 2n($H_2O$) = 2 · 2.7 / 18 = 0.3 моль
$n(H)_{общее}$ = 0.05 + 0.3 = 0.35 моль
m(H) = 1 · 0.35 = 0.35 г
в) m(C) = 6.15 – (4 + 0.35) = 1.8 г; n(C) = 1.8 / 12 = 0.15 моль
2) Находим молекулярную формулу вещества:
а) $M(C_xH_yBr)$ = 6.15 / 0.05 = 123 г/моль
б) x : y : z = n(C) : n(H) : n(Br) = 0.15 : 0.35 : 0.05 = 3 : 7 : 1
Вычисленная формула — $C_3H_7Br$.
$M(C_3H_7Br)$ = 36 + 7 + 80 = 123 г/моль
$M(C_xH_yBr)$ / $M(C_3H_7Br)$ = 123 / 123 = 1
Формула галогенпроизводного — $C_3H_7Br$
3) Структурная формула — $CH_3–CH(Br)–CH_3$
4) Уравнение реакции вещества с водным раствором гидроксида натрия:
$CH_3–CHBr–CH_3 + NaOH → NaBr + CH_3–CH(OH)–CH_3$
Ответ:
Задача 3
В результате сплавления органического вещества с гидроксидом калия был получен углеводород, 1,17 г паров которого занимают объём 336 мл (н. у.). Известно, что исходное вещество относится к классу солей. В этом соединении число атомов кислорода равно числу атомов водорода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом калия при сплавлении (используйте структурные формулы органических веществ).
Решение
1) Находим молярную массу углеводорода.
Пусть формула полученного углеводорода $C_xH_y$.
$n = V_г$ / $V_M$; $n(C_xH_y)$ = 0.336 / 22.4 = 0.015 моль
$M(C_xH_y) = m_{в-ва}$ / n = 1.17 / 0.015 = 78 г/моль
2) Находим молекулярную формулу углеводорода:
12x + y = 78
если x = 6, y = 6
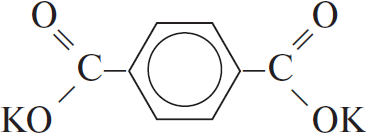
Формула углеводорода — $C_6H_6$, молекулярная формула исходного вещества $C_8H_4O_4K_2$.
3) Составляем структурную формулу соли:
4) Уравнение реакции:
$KOOC–C_6H_4–COOK + 2KOH → 2K_2CO_3 + C_6H_6$
Ответ:
Задача 4
Вещество, которое содержит 61,54 % кислорода, 34,62 % углерода и 3,84 % водорода по массе, было получено при взаимодействии углеводорода состава $С_5H_8$ с раствором перманганата калия в присутствии серной кислоты.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного углеводорода с подкисленным раствором перманганата калия (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав вещества.
Пусть $m_{в-ва}$ = 100 г, тогда:
а) m(C) = 34.62 г, n(C) = 34.62 / 12 ≈ 2.89 моль
б) m(H) = 3.84 г, n(H) = 3.84 / 1 = 3.84 моль
в) m(O) = 61.54 г, n(O) = 61.54 / 16 ≈ 3.85 моль
2) Находим молекулярную формулу вещества:
x : y : z = n(C) : n(H) : n(O) = 2.89 : 3.84 : 3.85 ≈ 1 : 1.33 : 1. 33 ≈ 3 : 4 : 4.
Молекулярная формула — $C_3H_4O_4$.
3) Структурная формула —
4) Уравнение реакции окисления углеводорода:
$CH_2=CH–CH_2–CH=CH_2 + 4KMnO_4 + 6H_2SO_4 → 2K_2SO_4 + 4MnSO_4 + 8H_2O + 2CO_2 +$
Ответ:
Задача 5
При сгорании 1,8 г органического вещества, не содержащего кислорода, получили углекислый газ, 2,52 г воды и 448 мл (н. у.) азота. Известно, что вещество не может быть получено восстановлением соответствующего нитросоединения, но вступает в реакцию c хлорэтаном.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с хлорэтаном (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yN_z$.
1) Количественный состав образца:
М(C) = 12 г/моль, М(H) = 1 г/моль, М(N) = 14 г/моль, M($H_2O$) = 18 г/моль
n(H) = 2n($H_2O$) = 2 · 2.52 / 18 = 0.28 моль; m(H) = 0.28 · 1 = 0.28 г
n(N) = 2n($N_2$) = 2 · 0.448 / 22.4 = 0.04 моль; m(N) = 0.04 · 14 = 0.56 г
m(C) = 1.8 – 0.28 – 0.56 = 0.96 г; n(C) = 0.96 / 12 = 0.08 моль
2) Вычисленная формула:
x : y : z = n(C) : n(H) : n(N) = 0.08 : 0.28 : 0.04 = 2 : 7 : 1
Вычисленная формула — $C_2H_7N$.
3) Структурная формула — $CH_3–NH–CH_3$
4) Уравнение реакции: $CH_3–NH–CH_3 + C_2H_5Cl → [(CH_3)_2NH(C_2H_5)]^{+}Cl^{–}$
Ответ:
Задача 6
Некоторое вещество было получено при окислении циклического углеводорода, не содержащего заместителей в цикле, перманганатом калия в присутствии серной кислоты. Это вещество содержит 40,68 % углерода, 54,24 % кислорода и 5,08 % водорода по массе.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного органического вещества с перманганатом калия в присутствии серной кислоты (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца.
Пусть $m_{в-ва}$ = 100 г, тогда
m(C) = 40.68 г; n(C) = 40.68 / 12 = 3.39 моль
m(H) = 5.08 г; n(H) = 5.08 / 1 = 5.08 моль
m(O) = 54.24 г; n(O) = 54.24 / 16 = 3.39 моль
2) Находим молекулярную формулу:
x : y : z = n(C) : n(H) : n(O) =
= 3.39 : 5.08 : 3.39 =
= 1 : 1.5 : 1 = (умножаем на 2)
= 2 : 3 : 2 = (умножаем на 2)
= 4 : 6 : 4
Вычисленная формула — $C_4H_6O_4$.
3) Структурная формула вещества —
4) Уравнение реакции окисления циклического углеводорода:
5 
Ответ:
Задача 7
При сгорании 11,6 г органического вещества выделилось 13,44 л (н. у.) углекислого газа и 10,8 мл воды. Плотность паров этого вещества равна 2,59 г/л. Вещество реагирует с гидроксидом меди(II).
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с свежеосажденным гидроксидом меди(II) (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца:
а) n(C) = n($CO_2$) = 13.44 / 22.4 = 0.6 моль
m(C) = 0.6 · 12 = 7.2 г
б) m($H_2O$) = 1 · 10.8 = 10.8 г; n(H) = 2n($H_2O$) = 2 · 10.8 / 18 = 1.2 моль
m(H) = 1 · 1.2 = 1.2 г
в) m(O) = 11.6 – 7.2 – 1.2 = 3.2 г; n(O) = 3.2 / 16 = 0.2 моль
2) Находим молекулярную формулу вещества:
а) x : y : z = n(C) : n(H) : n(O) = 0.6 : 1.2 : 0.2 = 3 : 6 : 1
Вычисленная формула — $C_3H_6O$.
M($C_3H_6O$) = 12 · 3 + 6 + 16 = 58 г/моль
б) M($C_xH_yO_z$) = 2.59 · 22.4 / 1 = 58,016 ≈ 58 г/моль
в) M($C_xH_yO_z$) / M($C_3H_6O$) = 58 : 58 = 1
Молекулярная формула — $C_3H_6O$.
3) Структурная формула вещества — $CH_3–CH_2–CHO$
4) Составляем уравнение реакции окисления пропаналя:
$CH_3–CH_2CHO + 2Cu(OH)_2 → CH_3–CH_2–COOH + Cu_2O + 2H_2O$
Ответ:
Задача 8
Массовая доля водорода 2,06, углерода 24,74 %, кислорода 32,99 %, калия 40,21 %. Вещество реагирует с гидроксидом калия с образованием углеводорода.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом калия (используйте структурные формулы органических веществ).
Решение
1) Находим молекулярную формулу вещества.
Пусть формула вещества — $C_xH_yO_zK_t$ и $m_{образца}$ = 100 г, тогда
а) m(C) = 24.74 г, n(C) = 24.74 / 12 ≈ 2.06 моль
m(H) = 2.06 г, n(H) = 2.06 / 1 = 2.06 моль
m(O) = 32.99 г, n(O) = 32.99 / 16 ≈ 2.06 моль
m(K) = 40.21 г, n(K) = 40.21 / 39 ≈ 1.03 моль
б) x : y : z : t = n(C) : n(H) : n(O) : n(K) = 2.06 : 2.06 : 2.06 : 1.03 =
= (2.06 / 1.03) : (2.06 / 1.03) : (2.06 / 1.03) : (1.03 / 1.03) ≈ 2 : 2 : 2 : 1 =
= 4 : 4 : 4 : 2
Молекулярная формула — $C_4H_4O_4K_2$.
2) Структурная формула — $KO–CO–CH_2–CH_2–CO–OK$ или $(KOOC–CH_2CH_2–COOK)$
3) Уравнение реакции:
$KO–CO–CH_2–CH_2–CO–OK + 2KOH → 2K_2CO_3 + CH_3–CH_3$
Ответ:
Задача 9
Органическое вещество содержит 45,45 % углерода, 6,06 % водорода и 48,48 % кислорода. Известно, что при нагревании с раствором гидроксида натрия образуется несколько новых веществ, причём одно из них имеет разветвлённое строение. На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия (используйте структурные формулы органических веществ).
Решение
Вариант ответа:
Пусть формула вещества $C_xH_yO_z$ и $m_{образца}$ = 100 г, тогда:
а) m(C) = 45,45 г, n(C) = 45,45/12 ≈ 3,79 моль
m(H) = 6,06 г, n(H) = 6,06/1 = 6,06 моль
m(O) = 48,48 г, n(O) = 48,48/16 ≈ 3,03 моль
б) x : y : z = n(C) : n(H) : n(O) = 3,79 : 6,06 : 3,03 = (3,79/3,03) : (6,06/3,03) : (3,03/3,03) ≈ 1,25 : 2 : 1 = 5 : 8 : 4
Молекулярная формула вещества: $C_5H_8O_4$.
Структурная формула: $HO–CO–CO–OCH(CH_3)_2$
$(HOOC–COO–CH(CH_3)_2)$
Уравнение щелочного гидролиза сложного эфира:
$HO–CO–CO–OCH(CH_3)_2 + 2NaOH_{(водн.)} → CH_3–CH(OH)–CH_3 + NaO–CO–CO–ONa + H_2O$
Ответ: