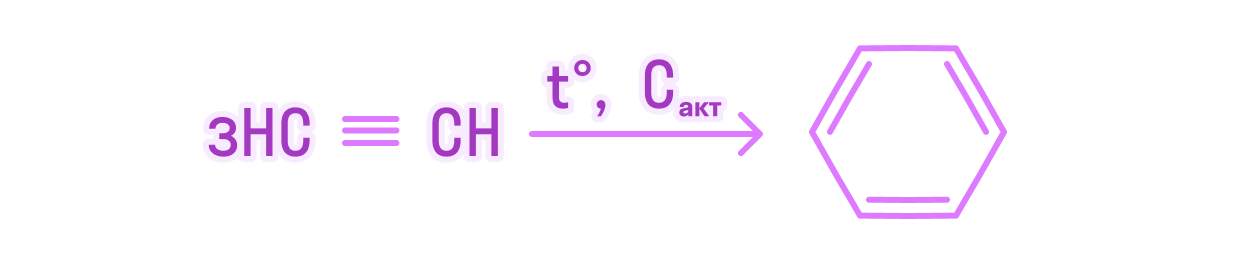Муниципальное казенное общеобразовательное учреждение
«Средняя общеобразовательная школа №2 п. Теплое имени кавалера ордена Красной Звезды К.Н.Емельянова »
Тепло-Огаревского района Тульской области
|
Рассмотрено на заседании ШМО учителей ______________________ _______ Панфёрцева Н.А. № протокола ______ «___»____________2019г. |
СОГЛАСОВАНО Заместитель директора по УВР _______________ Буева Т.Н. «___» ____________ 2019г. |
УТВЕРЖДАЮ Директор МКОУ «СОШ №2 п. Теплое» _____________ Лобанова Л.В. «___»______________2019 г. |
РАБОЧАЯ ПРОГРАММА
ЭЛЕКТИВНЫЙ КУРС
«ПОДГОТОВКА К ЕГЭ ПО ХИМИИ»
|
Название учебного курса |
химия |
|
Ступень обучения |
Среднее (полное) общее образование |
|
Срок реализации |
1 год |
|
Класс (классы) |
11 |
|
Составитель (составители) |
учитель химии |
|
Панферцева Наталья Александровна |
|
Теплое
2019
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Рабочая программа по химии составлена на основе
— Федерального государственного образовательного стандарта среднего общего образования, утвержденного приказом Министерства образования и науки РФ от 17 мая 2012 г. № 413 с изменениями и дополнениями (далее – ФГОС);
— Примерной основной образовательной программы среднего общего образования (одобрена решением федерального учебно-методического объединения по общему образованию (протокол от 28 июня 2016 г. № 2/16-з);
— Образовательной программы среднего общего образования муниципального казенного общеобразовательного учреждения «Средняя общеобразовательная школа №2 п. Теплое имени кавалера ордена Красной Звезды К.Н. Емельянова».
Элективный курс «Подготовка к ЕГЭ по химии» предназначен для учащихся 11 класса. Курс рассчитан на 34 часа (1 час в неделю).
ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОСВОЕНИЯ УЧЕБНОГО КУРСА
Учащиеся, изучившие факультативный курс должны:
характеризовать общие свойства химических элементов и их соединений на основе положения в периодической системе Д.И. Менделеева; состав, свойства и применении веществ; факторы, влияющие на изменение скорости химической реакции и состояние равновесия;
объяснять закономерности в изменении свойств веществ, сущность химических реакций;
составлять формулы веществ, схемы строения атомов, уравнения химических реакций различных типов;
называть и определять вещества, их свойства, признаки классификации веществ, типы химических реакций и др.;
планировать и проводить эксперимент по получению и распознаванию важнейших неорганических и органических соединений с учетом знаний о правилах безопасной работы с веществами в лаборатории и в быту; вычисления по химическим формулам и уравнениям.
Специфика данного курса предусматривает обязательную самостоятельную работу учащихся, способствующую более глубокому и осмысленному усвоению учебного материала, успешной подготовке к сдаче ЕГЭ.
СОДЕРЖАНИЕ УЧЕБНОГО КУРСА
Введение (1 час)
Структура экзаменационной работы. Распределение заданий по разделам, содержанию и видам умений и уровню сложности. Знакомство учащихся с условиями проведения экзамена, с системой оценивания отдельных заданий и работы в целом.
Теоретические основы химии (14 часов)
Современные представления о строении атома. Изотопы. Строение электронных оболочек атомов элементов I – IV периодов. Атомные орбитали, их виды; s-, p- d-элементы. Электронные конфигурации атомов. Основное и возбужденное состояние атомов. Периодический закон и периодическая система химических элементов Д.И. Менделеева. Закономерности изменения свойств элементов и их соединений по периодам и группам.
Виды химической связи: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Способы образования ковалентной связи. Характеристики ковалентной связи (полярность, энергия связи).
Электроотрицательность. Степень окисления и валентность химических элементов. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Химическая реакция. Классификация химических реакций в неорганической и органической химии. Тепловой эффект химических реакций, термохимические уравнения. Скорость химической реакции и ее зависимость от различных факторов (природа реагирующих веществ, концентрация, температура, площадь соприкосновения реагирующих веществ, катализатор). Обратимые и необратимые химические реакции. Химическое равновесие и условия его смещения. Принцип Ле Шателье.
Электролитическая диссоциация электролитов в водных растворах. Слабые и сильные электролиты. Реакции ионного обмена. Гидролиз. Типы гидролиза солей. Среда водных растворов: кислая, нейтральная, щелочная.
Окислительно-восстановительные реакции. Электролиз расплавов и растворов солей и щелочей.
Неорганическая химия (13 часов)
Классификация и номенклатура неорганических веществ (тривиальная и международная). Металлы. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, алюминия, переходных металлов – меди, цинка, хрома, железа. Коррозия металлов и способы защиты от нее. Общие способы получения металлов. Характерные физические и химические свойства оксидов металлов и соответствующих им гидроксидов.
Неметаллы. Характерные химические свойства простых веществ — неметаллов. Водородные соединения неметаллов. Характерные химические свойства оксидов неметаллов и соответствующих им гидроксидов.
Взаимосвязь между классами неорганических веществ.
Решение задач (6 ч)
Расчеты с использованием понятия «массовая доля вещества в растворе». Расчеты объёмных отношений газов при химических реакциях. Расчёты по термохимическим уравнениям. Задачи на смеси веществ. Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса. Нахождение массы или массовой доли одного из исходных веществ по уравнению материального баланса.
ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
|
№ п/п |
Раздел |
Тема урока |
Коли-чество часов |
|
1 |
Введение (1 ч) |
Структура экзаменационной работы. Знакомство с условиями проведения экзамена, с системой оценивания отдельных заданий и работы в целом. |
1 |
|
2 |
Теоретические основы химии (14 ч) |
Современные представления о строении атома. |
1 |
|
3 |
Периодический закон и периодическая система химических элементов Д.И. Менделеева. |
1 |
|
|
4 |
Виды химической связи. |
1 |
|
|
5 |
Электроотрицательность. Степень окисления и валентность химических элементов. |
1 |
|
|
6 |
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения. |
1 |
|
|
7 |
Классификация химических реакций в неорганической и органической химии. Тепловой эффект химических реакций. |
1 |
|
|
8 |
Скорость химической реакции. Факторы, влияющие на скорость химических реакций. |
1 |
|
|
9 |
Химическое равновесие. Принцип Ле Шателье. |
1 |
|
|
10 |
Электролитическая диссоциация электролитов в водных растворах. |
1 |
|
|
11 |
Реакции ионного обмена. |
1 |
|
|
12 |
Гидролиз. |
1 |
|
|
13 |
Окислительно-восстановительные реакции. |
1 |
|
|
14 |
Составление окислительно-восстановительных реакций. |
1 |
|
|
15 |
Электролиз. |
1 |
|
|
16 |
Неорганическая химия (13 ч) |
Классификация и номенклатура неорганических веществ. |
1 |
|
17 |
Характерные химические свойства простых веществ – металлов. |
1 |
|
|
18 |
Химические свойства металлов. |
1 |
|
|
19 |
Общие способы получения металлов. |
1 |
|
|
20 |
Коррозия металлов. |
1 |
|
|
21 |
Характерные химические свойства оксидов металлов. |
1 |
|
|
22 |
Химические свойства гидроксидов металлов. |
1 |
|
|
23 |
Характерные химические свойства простых веществ – неметаллов. |
1 |
|
|
24 |
Водородные соединения неметаллов. |
1 |
|
|
25 |
Характерные химические свойства оксидов неметаллов. |
1 |
|
|
26 |
Характерные химические свойства гидроксидов неметаллов. |
1 |
|
|
27 |
Взаимосвязь между классами неорганических веществ. |
1 |
|
|
28 |
Взаимосвязь между классами неорганических веществ. |
1 |
|
|
29 |
Решение задач (6 ч) |
Расчеты с использованием понятия «массовая доля вещества в растворе». |
1 |
|
30 |
Расчеты объёмных отношений газов при химических реакциях. |
1 |
|
|
31 |
Расчёты по термохимическим уравнениям. |
1 |
|
|
32 |
Задачи на смеси веществ. |
1 |
|
|
33 |
Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса. |
1 |
|
|
34 |
Нахождение массы или массовой доли одного из исходных веществ по уравнению материального баланса. |
1 |
Подготовка к ЕГЭ по химии
Как проходит ЕГЭ по химии в 2023 году
На ЕГЭ по химии, как и в случае с большинством других предметов, ученик 11 класса должен будет справиться с 2 частями экзамена:
-
1-я часть: 28 заданий с кратким ответом;
-
2-я часть: 6 заданий с развернутым ответом.
Чтобы решить все 34 задания единого государственного экзамена, у ученика будет 210 минут. За это время нужно будет успеть ответить на вопросы обеих частей, подготовить полное решение для задач 2-й части и перенести ответы в бланк.
Кстати, в отличие от ОГЭ, на ЕГЭ по химии не будет задания-эксперимента. Только обычные химические задания разной сложности. В таблице ниже можно посмотреть, сколько будет легких, средних и сложных вопросов.
| Уровень сложности заданий на ЕГЭ по химии | |
|---|---|
| Базовая | 17 |
| Повышенная | 11 |
| Высокая | 6 |
Если вы хотите больше узнать об особенностях экзамена и подготовки к нему, советуем заглянуть в раздел «Демоверсии, спецификации, кодификаторы» сайта ФИПИ. Там вы найдете всю актуальную информацию о ЕГЭ по химии и методические рекомендации. Все это поможет распланировать подготовку к экзамену так, чтобы сдать его на 100 баллов.
Изменения в ЕГЭ по химии
По сравнению с 2022 годом экзамен по химии немного изменится. Вот список нововведений:
-
Немного поменялось условие задания 23, в котором нужно рассчитать концентрацию веществ. Теперь данные в нем будут записаны текстом, а не в таблице.
-
Задания 33 и 34 поменялись местами.
-
Задания 9, 12 и 16 теперь станут повышенной сложности.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Демоурок по подготовке к экзаменам
Составим ваш личный путь к высоким баллам — учтем сроки, уровень знаний и цель.
Как хорошо сдать ЕГЭ по химии: разбор сложных задач
Как мы узнали из таблицы в предыдущем разделе, экзамен по химии — один из самых сложных. На 34 задания в нем приходится целых 11 повышенной сложности и 6 — высокой. Но если вы хотите поступить в вуз мечты, советуем научиться их решать так, чтобы не упустить ни одного балла. А потому предлагаем начать подготовку прямо сейчас и вместе разобрать несколько таких задач.
Задание 7
Это задание проверяет буквально все ваши знания в области неорганической химии. Здесь нужно знать как химические свойства простых соединений, так и химические свойства сложных соединений. Давайте разберем одно из таких заданий, чтобы понять, как их решать, чтобы сдать ЕГЭ по химии.
Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Вещество | Реагенты |
|---|---|
| А) S | 1) AgNO3, K3PO4, Cl2 |
| Б) SO3 | 2) BaO, NaOH, H2O |
| В) Zn(OH)2 | 3) H2, Cl2, O2 |
| Г) ZnBr2 | 4) HBr, LiOH, CH3COOH (p-p) |
| 5) H3PO4 (p-p), BaCl2, CuO |
Решение:
-
Вариант под буквой А — простое вещество, сера. Как правило, простые вещества взаимодействуют с другими простыми веществами, значительно реже со сложными веществами. Под это описание подходит вариант № 3.
-
Вещество под буквой Б — кислотный оксид. Кислотные оксиды не реагируют с кислотами, поэтому смело вычеркиваем варианты, где присутствует хоть одна кислота. Остаются варианты № 1–3. Реагенты под цифрой 3 тоже можем вычеркнуть, так как кислотный оксид уже в своей максимальной степени окисления и дальше взаимодействовать с кислородом не может. Остаются варианты № 1 и № 2. Оксид серы (VI) может реагировать с основным оксидом с образованием соли, со щелочью с образованием соли и воды, и с водой, при этом образуя кислоту. Выбираем № 2.
-
Амфотерный нерастворимый в воде гидроксид цинка может взаимодействовать только с теми, что способны его растворить. Единственно верный вариант под № 4, где указаны кислоты и щелочь.
-
При взаимодействии соли с другими сложными веществами надо помнить про три признака протекания химической реакции: выпадения осадка, выделение газа и образование малодиссоциирующего вещества — воды. Под это описание подходит вариант под № 1. Но как же хлор? Дело в том, что вышестоящие в группе галогены способны вытеснить нижестоящие из их солей.
Ответ: 3241.
Задание 15
Это задание Единого государственного экзамена проверит ваши знания химических свойств органических соединений. Чтобы справиться с ним, нужно по записанным словами реагирующим веществам составить уравнение реакции и выбрать из перечня один из получившихся продуктов. Давайте рассмотрим на примере, как решать такую задачу.
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Реагирующие вещества | Продукт взаимодействия |
|---|---|
| А) уксусная кислота и сульфид калия | пропионат калия |
| Б) муравьиная кислота и гидроксид калия | этилат калия |
| В) муравьиный альдегид и гидроксид меди (II) при нагревании | формиат меди (II) |
| Г) этанол и калий | формиат калия |
| ацетат калия | |
| углекислый газ |
Решение:
-
Органические кислоты могут реагировать с солями, если те имеют летучий анион. В результате взаимодействия образуется соль уксусной кислоты и сероводород (летучее соединение). Соль, которая образована в таких условиях, — ацетат калия. Это вещество № 5.
-
Муравьиная кислота проявляет свойства неорганической кислоты и может взаимодействовать с щелочами с образованием соли и воды. Соль муравьиной кислоты — формиат. Правильный ответ № 4.
-
Под буквой В описана качественная реакция на альдегиды с образованием соответствующей кислоты, оксида меди (I) и воды. Исключение — муравьиный альдегид. Он окисляется до углекислого газа, а остальные продукты реакции те же. Соответственно, правильный ответ № 6.
-
Калий как активный металл может замещать протон водорода в гидроксогруппе у спиртов с образованием алкоголята. Правильный ответ: № 2.
Ответ: 5462.
Задание 16
Это задание всё так же проверяет ваши знания по химическим свойствам и, как следствие, умение записывать превращения в рамках органической химии. Однако оно усложняется тем, что теперь вам самим нужно подобрать такой реактив, чтобы произошло уже известное превращение. Давайте попробуем решить один из вариантов такой задачи вместе — это повысит ваши шансы сдать ЕГЭ на 100 баллов.
Задана схема превращений веществ:
Определите, какие из указанных веществ являются веществами х и у:
-
2-бромбутан;
-
этаналь;
-
этен;
-
метилпропан;
-
хлорэтан.
Решение:
Посмотрим, что случилось с известными нам веществами.
-
У спирта исчезла ОН-группа, затем что-то произошло, и углеродная цепочка увеличилась вдвое. Мы помним, что когда цепочка увеличивается вдвое, то, скорее всего, это реакция Вюрца. А в неё вступают только галогеналканы. Ищем нужный нам вариант. Он находится под номером 5. Первое вещество найдено.
-
Бутан подвергают нагреванию с использованием катализатора. Нужно помнить, что в таких условиях проводится изомеризация алканов. Из бутана получается метилпропан. Ответ: № 4.
Ответ: 54.
Задание 26
Теперь разберем задачи, которые заканчивают тестовую часть ЕГЭ по химии. Рассмотрим условие одной из них на нахождение массы соли, которую необходимо добавить для получения раствора с новой заданной массовой долей.
Вычислите массу нитрата калия (в граммах), которую следует растворить в 160 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ округлите до десятых.
Чтобы решить эту задачу, вспомним основную формулу нахождения массовой доли:
-
Найдем массу изначально растворенного нитрата калия в растворе, выразив из формулы выше:
подставим значения:
-
Чтобы увеличить массовую долю соли в растворе, необходимо ее добавить еще. Но мы не знаем сколько, поэтому примем массу добавляемой соли за Х и подставим в исходную формулу нахождения массовой доли с учетом новых значений:
-
Далее в дело вступает чистая математика. Разделим обе части уравнения на 100%:
-
По пропорции перемножим крест-накрест:
0,12 * (160 + X) = 16 + X.
-
Раскроем скобки:
19,2 + 0,12Х = 16 + Х.
-
Приведем подобные: с Х в одну сторону, без Х — в другую:
3,2 = 0,88Х.
-
Найдем Х:
Масса нитрата калия, которую необходимо добавить для увеличения массовой доли раствора до 12%, равна 3,6 граммам.
Ответ: 3,6.
Задание 28
Эта задача может встретиться на экзамене в нескольких вариантах. Давайте разберем один из них — задание на нахождение доли выхода продукта реакции.
В результате реакции тримеризации ацетилена объемом 26,88 л (н.у) получили 24,96 г бензола. Вычислите массовую долю выхода продукта реакции от теоретически возможного.
Решение:
-
Для начала напишем формулу, по которой считается доля выхода продукта:
Как определить, какая масса практическая, а какая — теоретическая? Значения, которые даются после слова «получили», — это практическая масса. Та, которая получилась в результате проведения химической реакции в реальных условиях. Масса теоретическая — та, которую рассчитывают из уравнения реакции, зная массу исходных реагентов.
-
Напишем уравнение химической реакции тримеризации ацетилена:
-
Найдем количество вещества ацетилена:
подставим значения:
-
Перейдем на количество вещества бензола, получаемого из ацетилена:
-
Зная количество вещества бензола, найдем его массу:
подставим значения:
m = 0,4 * 78 = 31,2 грамма.
-
Масса, рассчитываемая по уравнению реакции, является теоретической. Масса практическая дана нам по условию. Подставим полученные данные по массам в формулу для нахождения доли выхода продукта реакции:
Доля выхода бензола из данного объема ацетилена составляет 80%.
Ответ: 80.
Как оценивают готовые работы на ЕГЭ по химии
1-я часть
В 1-й части Единого государственного экзамена по химии задания 1–5, 9–13, 16–21, 25–28 оценивают 1 баллом, если вы запишете верный ответ по эталону. При этом в заданиях 1, 3, 4, 11, 12, 13, 17 и 18 ответ — это ряд цифр. То, в каком порядке вы их запишете, не влияет на оценку. Например, если в задании верны варианты под номерами 1 и 4, их можно записать как 14 или как 41. И в обоих случаях ответ засчитают как верный.
За правильные ответы в заданиях 6, 7, 8, 14, 15, 22, 23 и 24 можно получить по 2 балла. Если ваш ответ отличается от эталона на один символ, его оценят в 1 балл. Во всех остальных случаях задание считают выполненным неверно и ставят 0 баллов.
2-я часть
В этой части нужно записать не только ответ, но и решение. А значит, и оценивать такие задания будут сразу по нескольким критериям. Зато за верный ответ в некоторых вопросах можно получить больше баллов, чем за любое задание 1-й части. Максимум — 5 баллов. А теперь давайте разберемся, как именно их будут оценивать.
| Задание № 29 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества и записал уравнение химической реакции, составил электронный баланс, указал окислитель и восстановитель | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 30 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества, записал все нужные уравнения реакции | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 31 | Баллы |
|---|---|
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 4 |
| Задание № 32 | Баллы |
|---|---|
| Правильно записаны 5 уравнений реакции | 5 |
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 5 |
| Задание № 33 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 3 элемента | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 3 |
| Задание № 34 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 4 элемента | 4 |
| Правильно записаны только 3 элемента ответа | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 4 |
Как сдать ЕГЭ по химии на 3, 4 и 5
Мы уже познакомились с критериями, по которым будут оценивать работы на ЕГЭ. А теперь давайте разберемся, сколько баллов нужно получить для оценок 3, 4 или 5. Официально ЕГЭ не оценивают по пятибалльной системе с 2008 года. Если вам так проще оценить свои знания, их можно перевести. Но это будет лишь примерный перевод.
Будьте внимательны: баллы из таблиц выше — первичные, а требования к абитуриентам на поступление выражены в тестовых. Чтобы понять, сколько заданий точно нужно решить, чтобы поступить, надо перевести баллы из одной системы в другую. Это можно сделать по таблице ниже.
| Первичные баллы | Тестовые баллы | Оценка |
|---|---|---|
| <11 | <36 | 2 |
| 11–25 | 36–55 | 3 |
| 26–38 | 56–72 | 4 |
| 39–56 | 73–100 | 5 |
6 рекомендаций, как подготовиться к ЕГЭ по химии
Единый государственный экзамен — это ответственная задача, от результатов подготовки к которой иногда многое зависит. Чтобы немного облегчить для вас этот путь, мы собрали 6 простых, но рабочих советов от наших преподавателей. Следуйте им и тогда сможете подготовиться к экзамену по химии как можно лучше.
-
Узнайте все о структуре ЕГЭ и научитесь работать с КИМами.
-
Начинайте готовиться заранее. Но если получилось так, что осталось мало времени, составьте новый экспресс-план с помощью вашего преподавателя.
-
Ведите календарь подготовки к экзамену. Отмечайте на нем запланированные темы, разные методики, занятия у репетитора, пробные ЕГЭ и самоподготовку.
-
Распределяйте время на темы, исходя из ваших знаний. Больше учите то, что «западает», остальное — повторяйте.
-
Советуйтесь с учителем. Это может быть ваш преподаватель по химии или репетитор. Круто, если он сможет поделиться с вами опытом подготовки к ЕГЭ.
-
Заботьтесь о своем здоровье, не забывайте отдыхать, не лишайте себя живого общения. Все это может сказаться на вашем самочувствии, а значит, и баллах тоже.
Если вы хотите сдать ЕГЭ по химии на 100 баллов, советуем тщательно продумать, как вы будете готовиться к нему. Лучший из них — совмещать самостоятельную работу и дополнительные занятия.
На курсах подготовки к ЕГЭ по химии в Skysmart школьники отрабатывают все типы задач и разбирают критерии оценок. Для каждого из них мы составляем индивидуальный план, который приведет к нужным баллам. Он учитывает уровень знаний ученика и время до экзамена, что позволяет «выжать» максимум из подготовки. А еще мы рассказываем о ЕГЭ без «страшилок» и прикрас, чтобы школьник точно знал, что его ждет на экзамене. Ждем на первом бесплатном занятии!
Смотреть видео:
#химия #химияпросто #неорганика #егэпохимии #эксперименты #химик #егэхимия #неорганическая_химия #огэхимия
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

План подготовки к ЕГЭ по химии | Химия ЕГЭ 2022 | Parta
Parta химия ЕГЭ

Беспроигрышный план подготовки к органике | ЕГЭ ХИМИЯ 2022 | СОТКА
Химия ЕГЭ сотка

План подготовки к ЕГЭ по химии | Химия ЕГЭ | Parta
Parta химия ЕГЭ

План подготовки к ЕГЭ по химии | Химия ЕГЭ 2023 | Parta
Parta химия ЕГЭ
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
29.06.2021
Приложение
к
основной образовательной программе
среднего
общего образования ( для 7-9 кл)
приказ
№______от __________________ г
Рабочая программа
элективного курса
«Системное повторение курса химии» 11 класс
2021 -2022учебный год
Предмет: Химия
Уровень: общеобразовательный
УчительПопехина Т,в.
2021 г.
С.
Замишево.
Пояснительная
записка
Элективный курс «Подготовка
к ЕГЭ по химии» предназначен для учащихся 11-х классов и рассчитан на 34
часа (1 час в неделю).
Основной акцент при
разработке программы курса делается на решении задач по блокам: «Общая химия»,
«Неорганическая химия», «Органическая химия». Особое внимание уделяется
методике решения задач части В и С по контрольно- измерительным материалам
ЕГЭ.
Цели элективного
курса:
—
развитие познавательной деятельности обучающихся через активные формы и методы
обучения;
—
развитие творческого потенциала обучающихся, способности критически мыслить;
—
закрепление и систематизация знаний обучающихся по химии;
—
обучение обучающихся основным подходам к решению расчетных задач по химии,
нестандартному решению практических задач.
Задачи элективного
курса:
— подготовить выпускников к единому государственному экзамену по химии;
— развить
умения самостоятельно работать с литературой, систематически заниматься
решением задач, работать с тестами различных типов;
— выявить основные затруднения и
ошибки при выполнении заданий ЕГЭ по химии;
—
научить обучающихся приемам решения задач различных типов;
—
закрепить теоретические знания школьников по наиболее сложным темам курса
общей, неорганической и органической химии;
—
способствовать интеграции знаний учащихся по предметам
естественно-математического цикла при решении расчетных задач по химии;
—
продолжить формирование умения анализировать ситуацию и делать прогнозы.
Тематическое
планирование по элективному курсу
«Подготовка
к ЕГЭ по химии»
|
№ п/п |
Наименование разделов и тем |
Максимальная нагрузка учащегося, ч. |
||
|
Теорети- ческое обучение, ч. |
||||
|
1. |
Структура |
1 |
1 |
|
|
2. |
Теоретические |
8 |
8 |
|
|
3. |
Неорганическая |
10 |
10 |
|
|
4. |
Органическая |
10 |
10 |
|
|
5. |
Обобщение |
5 |
5 |
|
|
Итого |
34 |
34 |
Содержание
элективного курса «Подготовка к ЕГЭ по химии»
Тема 1. Структура
контрольно-измерительных материалов ЕГЭ по химии. Особенности самостоятельной
подготовки школьников к ЕГЭ (1 час)
Спецификация ЕГЭ по
химии 2013 г. План экзаменационной работы ЕГЭ по химии 2013 г. (ПРИЛОЖЕНИЕ к
спецификации). Кодификатор элементов содержания по химии для составления КИМов
ЕГЭ 2013 г. Контрольно-измерительные материалы по химии 2011-2012 г. (анализ
типичных ошибок).
Характеристика
содержания части А ЕГЭ по химии 2017 г. Характеристика содержания части В
ЕГЭ по химии 2017 г. Характеристика содержания части С ЕГЭ по химии 2017
г.
Тема 2.
Теоретические основы химии. Общая химия (8 часов)
2.1. Химический
элемент
Современные
представления о строении атома. Строение электронных оболочек атомов элементов
первых четырех периодов: s-, p- и d-элементы. Электронная
конфигурация атома. Основное и возбужденное состояние атомов.
Периодический закон и
периодическая система химических элементов Д.И. Менделеева. Радиусы атомов, их
периодические изменения в системе химических элементов. Закономерности
изменения химических свойств элементов и их соединений по периодам и группам.
Понятие о радиоактивности.
2.2. Химическая
связь и строение вещества
Ковалентная химическая
связь, еѐ разновидности (полярная и неполярная), механизмы образования.
Характеристики ковалентной связи (длина и энергия связи). Ионная связь.
Металлическая связь. Водородная связь.
Электроотрицательность.
Степень окисления и валентность химических элементов. Вещества молекулярного и
немолекулярного строения. Зависимость свойств веществ от особенностей их
кристаллической решетки.
2.3. Химические
реакции
2.3.1. Химическая
кинетика
Классификация
химических реакций. Тепловой эффект химической реакции. Термохимические
уравнения. Скорость реакции, еѐ зависимость от различных факторов.
Обратимые и
необратимые химические реакции. Химическое равновесие. Смещение химического
равновесия под действием различных факторов.
2.3.2. Теория
электролитической диссоциации
Электролитическая
диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
Реакции ионного обмена.
Характерные химические
свойства оксидов: основных, амфотерных, кислотных. Характерные химические
свойства оснований и амфотерных гидроксидов. Характерные химические свойства
кислот. Характеристика основных классов неорганических соединений с позиции
теории электролитической диссоциации (ТЭД).
Характерные химические
свойства солей: средних, кислых, основных; комплексных (на примере соединений
алюминия и цинка). Гидролиз солей. Среда водных растворов: кислая, нейтральная,
щелочная. Водородный показатель (рН). Индикаторы. Определение характера среды
водных растворов веществ.
2.3.3.
Окислительно-восстановительные реакции.
Реакции
окислительно-восстановительные, их классификация Коррозия металлов и способы
защиты от неѐ. Электролиз расплавов и растворов (солей, щелочей, кислот).
Реакции, подтверждающие взаимосвязь различных классов неорганических
соединений.
2.4. Решение
тренировочных задач по теме: «Теоретические основы химии. Общая химия» » (по
материалам КИМов ЕГЭ 2015, 2016, 2017 гг)
Вычисление массы
растворенного вещества, содержащегося в определенной массе раствора с известной
массовой долей. Расчеты: объемных отношений газов при химических реакциях.
Расчеты: теплового эффекта реакции. Расчеты: массовой доли (массы) химического
соединения в смеси. Написание уравнений окислительно-восстановительных реакций,
расстановка коэффициентов методом электронного баланса.
Тема 3.
Неорганическая химия (10 часов)
3.1. Характеристика
металлов главных подгрупп и их соединений
Общая характеристика
металлов главных подгрупп I–III групп в связи с их положением в периодической
системе химических элементов Д.И. Менделеева и особенности строения их атомов.
Характерные химические
свойства простых веществ и соединений металлов — щелочных, щелочноземельных,
алюминия.
3.2. Характеристика
неметаллов главных подгрупп и их соединений
Общая характеристика
неметаллов главных подгрупп IV–VII групп в связи с их положением в
периодической системе химических элементов Д.И. Менделеева и особенностями
строения их атомов.
Характерные химические
свойства простых веществ и соединений неметаллов — водорода, галогенов,
кислорода, серы, азота, фосфора, углерода, кремния.
3.3. Характеристика
переходных элементов и их соединений
Характеристика
переходных элементов – меди, цинка, хрома, железа по их положению в
периодической системе химических элементов Д.И. Менделеева и особенностям
строения их атомов.
Характерные химические
свойства простых веществ и соединений переходных металлов – меди, цинка, хрома,
железа.
3.4. Решение
тренировочных задач по теме: «Неорганическая химия» (по материалам КИМов ЕГЭ 2015,
2016, 2017 гг)
Расчеты: массы (объема,
количества вещества) продукта реакции, если одно из веществ дано в виде
раствора с определенной массовой долей растворенного вещества.
Расчеты: массовой или
объемной доли выхода продукта реакции от теоретически возможного. Расчеты:
массовой доли (массы) химического соединения в смеси. Определение рН среды
раствором солей.
Генетическая связь
между основными классами неорганических соединений. Качественные реакции на
неорганические вещества и ионы.
Тема 4.
Органическая химия (10 часов)
4.1. Углеводороды
Теория строения
органических соединений. Изомерия – структурная и пространственная. Гомологи и
гомологический ряд.
Типы связей в
молекулах органических веществ. Гибридизация атомных орбиталей углерода.
Радикал. Функциональная группа. Классификация и номенклатура органических
соединений.
Характерные химические
свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов.
Природные источники углеводородов, их переработка. Механизмы реакций
присоединения в органической химии. Правило В.В. Марковникова, правило Зайцева
А.М.
Характерные химические
свойства ароматических углеводородов: бензола и толуола. Механизмы реакций
электрофильного замещения в органических реакциях.
Высокомолекулярные
соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы,
волокна, каучуки.
4.2.
Кислородсодержащие органические соединения
Характерные химические
свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные
химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров.
Биологически важные вещества: углеводы (моносахариды, дисахариды, полисахариды).
Реакции, подтверждающие взаимосвязь углеводородов и кислородсодержащих
органических соединений.
Органические
соединения, содержащие несколько функциональных. Особенности химических
свойств.
4.3. Азотсодержащие
органические соединения и биологически важные органические вещества
Характерные химические
свойства азотсодержащих органических соединений: аминов и аминокислот.
Биологически важные вещества: жиры, белки, нуклеиновые кислоты. Гормоны.
Ферменты. Металлорганические соединения.
4.4. Решение
практических задач по теме: «Органическая химия» (по материалам КИМов ЕГЭ 2015,
2016, 2017 гг)
Нахождение
молекулярной формулы вещества. Генетическая связь между неорганическими и
органическими веществами. Генетическая связь между основными классами неорганических
веществ. Качественные реакции на некоторые классы органических соединений
(алкены, алканы, спирты, альдегиды, карбоновые кислоты, углеводы, белки).
Идентификация органических соединений.
Тема 5. Обобщение и
повторение материала за курс школьный химии (5 часов)
Основные понятия и
законы химии. Периодический закон Д.И.Менделеева и его физический смысл. Теория
строения органических веществ А.М. Бутлерова и особенности органических
соединений. Окислительно-восстановительные реакции в неорганической и
органической химии. Генетическая связь между неорганическими и органическими
соединениями. Экспериментальные основы органической и неорганической химии.
Работа с
контрольно-измерительными материалами ЕГЭ по химии.
Итоговый контроль в
форме ЕГЭ.
Требования
к уровню подготовки выпускников по результатам освоения
программы
элективного курса «Подготовка к ЕГЭ по химии»
Знать/Понимать:
Важнейшие
химические понятия
— выявлять характерные
признаки понятий: вещество, химический элемент, атом, молекула, относительные
атомные и молекулярные массы, ион, изотопы, химическая связь,
электроотрицательность, валентность, степень окисления, моль, молярная масса,
молярный объем, вещества молекулярного и немолекулярного строения, растворы,
электролиты и неэлектролиты, электролитическая диссоциация, гидролиз,
окислитель и восстановитель, окисление и восстановление, электролиз, скорость
химической реакции, химическое равновесие, тепловой эффект реакции, углеродный
скелет, функциональная группа, изомерия и гомология, структурная и
пространственная изомерия, основные типы реакций в неорганической и
органической химии;
— выявлять взаимосвязи
понятий, использовать важнейшие химические понятия для объяснения отдельных
фактов и явлений;
— принадлежность
веществ к различным классам неорганических соединений;
— гомологи, изомеры;
— химические реакции в
органической химии.
Основные законы
и теории химии:
— применять основные
положения химических теорий (строения атома, химической связи,
электролитической диссоциации, кислот и оснований, строения органических
соединений, химической кинетики) для анализа строения и свойств веществ;
— понимать границы
применимости указанных химических теорий;
— понимать смысл
Периодического закона Д.И. Менделеева и использовать его для качественного
анализа и обоснования основных закономерностей строения атомов, свойств
химических элементов и их соединений.
Важнейшие вещества
и материалы
— классифицировать
неорганические и органические вещества по всем известным классификационным
признакам;
— объяснять
обусловленность практического применения веществ их составом, строением и
свойствами;
характеризовать
практическое значение данного вещества;
— объяснять общие
способы и принципы получения наиболее важных веществ.
Уметь:
Называть
изученные вещества по тривиальной или международной номенклатуре.
Определять/классифицировать:
— валентность, степень
окисления химических элементов, заряды ионов;
— вид химических
связей в соединениях и тип кристаллической решетки;
— пространственное
строение молекул;
— характер среды
водных растворов веществ;
— окислитель и
восстановитель;
— принадлежность
веществ к различным классам неорганических и органических соединений;
— гомологи и изомеры;
— химические реакции в
неорганической и органической химии (по всем известным классификационным
признакам).
Характеризовать:
— s, p и d-элементы по их положению в Периодической системе
Д.И. Менделеева;
— общие химические
свойства простых веществ – металлов и неметаллов;
— общие химические
свойства основных классов неорганических соединений, свойства отдельных
представителей этих классов;
— строение и
химические свойства изученных органических соединений.
Объяснять:
— зависимость свойств
химических элементов и их соединений от положения элемента в Периодической
системе Д.И. Менделеева;
— природу химической
связи (ионной, ковалентной, металлической, водородной);
— зависимость свойств
неорганических и органических веществ от их состава и строения;
— сущность изученных
видов химических реакций (электролитической диссоциации, ионного обмена,
окислительно-восстановительных) и составлять их уравнения;
— влияние различных
факторов на скорость химической реакции и на смещение химического равновесия.
Решать задачи:
— вычисление массы
растворенного вещества, содержащегося в определенной массе раствора с известной
массовой долей;
— расчеты: объемных
отношений газов при химических реакциях;
— расчеты: массы
вещества или объема газов по известному количеству вещества, массе или объѐму
одного из участвующих в реакции веществ;
— расчеты: теплового
эффекта реакции;
— расчеты: массы
(объема, количества вещества) продуктов реакции, если одно из веществ дано в
избытке (имеет примеси);
— расчеты: массы
(объема, количества вещества) продукта реакции, если одно из веществ дано в
виде раствора с определенной массовой долей растворенного вещества;
— нахождение
молекулярной формулы вещества;
— расчеты: массовой
или объемной доли выхода продукта реакции от теоретически возможного;
— расчеты: массовой
доли (массы) химического соединения в смеси;
— составление цепочек
генетической связи химических соединений (неорганическая химия и органическая
химия).
Литература
Нормативная база элективного курса
1) Обязательный минимум содержания среднего
(полного) общего образования по химии (Приказ Минобразования России № 56 от
30.06.1999 г.).
2) Федеральный компонент государственных
стандартов основного общего и среднего (полного) общего образования по химии (Приказ
Минобразования России № 1089 от 05.03.2004 г.).
4) Спецификация экзаменационной работы по химии
единого государственного экзамена 2010 год.
5) Кодификатор элементов содержания по химии для
составления контрольных измерительных материалов единого государственного
экзамена 2010 год.
Литература для учителя (методическая по
подготовке школьников к ЕГЭ по химии)
1. Программа курса
химии для 8-11 классов общеобразовательных учреждений (автор Габриелян О.С.) и
примерная программа среднего полного общего образования по химии. Базовый
уровень (Сборник нормативных документов. Химия /составитель Э.Д.Днепрова,
9. Хомченко Г.П., Хомченко И.Г. Сборник задач по
химии для поступающих в вузы. – М.: Новая волна
Календарно-тематическое планирование
|
№ п/п |
Наименование |
Количе-ство |
Дата |
|
|
Плани-руемая |
Факти-ческая |
|||
|
1 |
Структура |
1ч |
||
|
1.1 |
Структура контрольно-измерительных материалов. |
1 |
||
|
2 |
Теоретические |
8ч |
||
|
2.1 |
Химический элемент и химическая связь. |
1 |
||
|
2.2 |
Решение задач по теме: «Химический элемент и |
1 |
||
|
2.3 |
Химическая кинетика. |
1 |
||
|
2.4 |
Решение задач по теме: «Химическая кинетика». |
1 |
||
|
2.5 |
Теория электролитической диссоциации. |
1 |
||
|
2.6 |
Решение задач по теме: «Теория |
1 |
||
|
2.7 |
Окислительно-восстановительные реакции. |
1 |
||
|
2.8 |
Решение задач по теме: |
1 |
||
|
3 |
Неорганическая |
10ч |
||
|
3.1 |
Характеристика металлов главных подгрупп и их соединений. |
1 |
||
|
3.2 |
Решение задач по теме: «Щелочные и |
1 |
||
|
3.3 |
Характеристика неметаллов главных подгрупп и |
1 |
||
|
3.4 |
Решение задач по теме: «Галогены». |
1 |
||
|
3.5 |
Решение задач по теме: «Подгруппа кислорода, |
1 |
||
|
3.6 |
Характеристика неметаллов главных подгрупп и |
1 |
||
|
3.7 |
Решение задач по теме: «Подгруппа азота». |
1 |
||
|
3.8 |
Решение задач по теме: «Подгруппа углерода». |
1 |
||
|
3.9 |
Характеристика металлов побочных подгрупп и их |
1 |
||
|
3.10 |
Решение задач по теме: «Характеристика |
1 |
||
|
4 |
Органическая |
10ч |
||
|
4.1 |
Теория строения органических соединений. |
1 |
||
|
4.2 |
Углеводороды – алканы, алкены, циклоалканы, |
1 |
||
|
4.3 |
Решение задач по теме: «Предельные |
1 |
||
|
4.4 |
Решение задач по теме: «Непредельные |
1 |
||
|
4.5 |
Ароматические углеводороды. |
1 |
||
|
4.6 |
Кислородсодержащие органические соединения (сравнительная |
1 |
||
|
4.7 |
Решение задач. |
1 |
||
|
4.8 |
Решение задач. |
1 |
||
|
4.9 |
Азотсодержащие органические соединения и |
1 |
||
|
4.10 |
Решение задач. |
1 |
||
|
5 |
Обобщение |
5ч |
||
|
5.1 |
Обобщение материала по теме школьного курса |
1 |
||
|
5.2 |
Обобщение материала по теме школьного курса |
1 |
||
|
5.3 |
Обобщение материала по теме школьного курса |
1 |
||
|
5.4 |
Итоговый контроль в форме ЕГЭ. |
1 |
||
|
5.5 |
Итоговый контроль в форме ЕГЭ. |
1 |
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии
Спецификация ЕГЭ по химии-2022

Подготовка к ЕГЭ начинается с
психологического настроя на успех, обязательную сдачу ЕГЭ.
Поэтому не
лишними будут помощь психолога, советы родителей и учителей.
Теория к ЕГЭ. Методика самостоятельной подготовки к ЕГЭ
ТЕОРИЯ ДЛЯ СДАЮЩИХ ЕГЭ
Дopoнькин ЕГЭ. Химия. Большой справочник
Adobe Acrobat Document
7.6 MB
РАСПЕЧАТАТЬ И ИСПОЛЬЗОВАТЬ
Методические рекомендации по подготовке
Adobe Acrobat Document
375.5 KB
ПРОРАБОТАТЬ И ПРИНЯТЬ К СВЕДЕНИЮ
анализ типичных ошибок ЕГЭ-2019 г.pdf
Adobe Acrobat Document
771.7 KB
ПРОГРАММА ПОДГОТОВКИ К ЕГЭ ПО ХИМИИ.doc
Microsoft Word Document
129.5 KB
ВНИМАНИЕ
Тривиальные названия органических вещест
Adobe Acrobat Document
340.1 KB
Теория и тест для самостоятельной проработки.
Основные способы получения металлов.pptx
Microsoft Power Point Presentation
920.7 KB
Все свойства органических веществ.
Реакции к основным темам курса 10 класса
Microsoft Word Document
158.0 KB
Общие формулы. УЧИТЬ!!!
Общие формулы классов органических вещес
Adobe Acrobat Document
188.4 KB
Металлы. Соединения металлов. УЧИТЬ!!!
Свойства металлов и их соединений.docx
Microsoft Word Document
2.5 MB
Цепочки превращений.
Задание С3. Цепочки превращений..docx
Microsoft Word Document
674.8 KB
Теория по основным классам неорганических соединений.
Основные классы и их свойства.doc
Microsoft Word Document
880.0 KB
Нужно разобраться и выучить.
Ряд активности металлов.pdf
Adobe Acrobat Document
315.0 KB

Документация и подготовка к ЕГЭ
таблица ПСХЭ.doc
Microsoft Word Document
396.5 KB
Таблица растворимости некоторых веществ
Microsoft Word Document
578.5 KB

Дополнительная информация, теория к ЕГЭ
Адреса сайтов подготовки.
Материалы для подготовки к ОГЭ и ЕГЭ.doc
Microsoft Word Document
15.2 KB
Таблица. Качественные признаки веществ.d
Microsoft Word Document
44.8 KB
Ряд ЭО. Названия кислот и остатков. Степ
Microsoft Word Document
518.7 KB
Таблица ПСХЭ . С обозначением классов со
Microsoft Word Document
498.4 KB
цвета оксидов.doc
Microsoft Word Document
24.0 KB
Номенклатура неорганических веществ.doc
Microsoft Word Document
135.5 KB
Определение ионов. Качественные реакции.
Microsoft Word Document
51.0 KB
Часть представленных здесь материалов взята с
сайта учителя химии Сикорской О.Э.
Химия хоть и считается одним из сложных дисциплин, но также можно сказать про все остальные экзамены. Одно из главных отличий — изучается по школьной программе чаще всего не слишком углубленно, чтобы сдать хотя бы на средне-высокий балл. Плюс, дисциплина идет с класса седьмого — и то изучается только один раздел, а последний и самый сложный блок изучается только последние 2 года.
Начинаем
Чтобы узнать, как проводится сам экзамен, нужно найти официальную информацию. Она всегда находится на сайте ФИПИ — они составители единого госэкзамена и всех городских тестирований. Они отвечают за проверку знаний у школьников по всем предметам. Перед началом учебного года у них на сайте всегда выходит проект, в котором находится три документа:
- Спецификация — отвечает на все организационные вопросы, которые могут возникнуть у школьников. Также там расписаны баллы, формулировки и структура. Так как в течение года он обычно не изменяется, советуем прочитать его в самом начале, чтобы точно разобраться во всех интересующих тебя аспектах.
- Кодификатор — в нем будут все темы, которые стоит пройти, чтобы полностью подготовить теоретическую базу для сдачи. Хорошей идеей будет составить план, по которому будешь готовиться, на его основе — таким образом точно не пропустишь важные темы. Или сделай из него чек-лист — отмечай каждый пройденный пункт, чтобы видеть свой прогресс. *Пометка — то, что указано курсивом, учить не надо, так как они обычно не встречаются в КИМах.
- Демоверсия — проект КИМа, который скорее всего будет в текущем году на госах. Там есть четкие формулировки, которые будут встречаться в контрольно-измерительных материалах, плюс критерии оценивания развернутых заданий. Советуем распечатать отсюда справочные материалы — таблицу Менделеева, растворимости, ряд активности металлов. Их именно в таком виде будут выдавать в индивидуальном пакете в аудитории, поэтому если будешь пользоваться, пока готовишься, привыкнешь к ним и будешь быстро ориентироваться.
Также попробуй немного схитрить — скачай заодно файлы для экспертов, которые проверяют вторую часть. Там поймешь, какие недочеты не допускать.
Понять свой уровень
Одна из главных частей для начала подготовки — узнать, насколько плохо ты разбираешься в предмете. Если осознаешь, что у тебя не совсем нулевые знания, то прорешай разок демоверсию — неважно, будет у тебя два балла, ноль или гораздо больше. Запиши свой результат, чтобы видеть прогресс в процессе нарешивания и выучивания новой информации.
Структура
Всего будет тридцать четыре задания: в тесте двадцать восемь, а развернутых шесть. В целом их всех можно разделить на несколько блоков:
- Теоретические основы — всего номеров пять и только в тесте.
- Реакции — будет восемь упражнений, из которых два в письменной части.
- Неорганические — семь задач, из которых всего лишь одна развернутая.
- Органические — четыре, плюс еще одна с открытым решением.
- Методы познания — всего лишь дважды спрашивается и только в тестовом виде.
- Расчеты по формулам — четыре раза в тестовом виде и дважды в письменном.
Обычно за объемную долю тестирования дается лишь по одному баллу, здесь это правило тоже будет — только за номера 6, 7, 8, 14, 15, 22, 23, 24 будет получено максимум 2.
Всего больших разделов, знания которых будут проверяться в КИМе, три:
- Общая — строение атома, периодический закон, химическая связь, кристаллические решетки, скорость реакции, химическое равновесие, тепловой эффект, расчетные задачи.
Она проходится в течение всего времени изучения дисциплины, но, конечно, больше всего ей времени уделено в начале обучения, так как она покрывает базу. Это достаточно легкая тема, но все еще вызывает много проблем в начале обучения. Если учишь полностью с нуля за год, тебе предстоит долго с ней просидеть, потому что она действительно охватывает самые основы. Поймешь, как все работает на базовом уровне — быстро схватишь, как протекают остальные процессы.
- Неорганика — оксиды, основания, кислоты и соли; металлы, неметаллы.
Она же изучается только до конца девятого класса — в ОГЭ проверяются знания по ней. Если ты сдавал ОГЭ по предмету, то тебе будет гораздо легче готовиться к тестированию в одиннадцатом.
- Органика — алканы, алкены, алкадиены, алкины, циклы, бензол и его гомологи; галогенопроизводные; спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, эфиры и жиры; амины, аминокислоты, углеводы и белки.
В целом для этой дисциплины теория и практика примерно равномерно распределена — над всем придется долго сидеть. Но это не значит, что тренироваться нужно столько же по времени, сколько учить новую информацию — на практику все еще делается упор. Обработаешь кучу задачек — улучшишь свои навыки, значит сможешь быстро делать все в аудитории. Не забывай, что время ограничено, и нужно уложиться в определенный промежуток, так еще и перепроверить и переписать все на бланки. Потренируйся дома с таймером — пиши пробники хотя бы раз в месяц, а лучше — раз в неделю. Ставь себе таймер, распечатывай КИМ, убери все ненужное со стола и сиди решай. Если у тебя проводятся в школе пробники — постоянно ходи на них: опыт получай как только угодно. Если несколько людей сдают у одного учителя, попробуйте попросить выделить вам немного дополнительных часов, чтобы решали в классе. Если еще учитель согласится проверять ваши письменные ответы — будет чудно. Если же препод не особо понимающий, то просто собирайтесь и проверяйте друг у друга, чтобы понимать, какие есть недочеты, и не допускать их.
Как составить систему
Когда составляешь план, во-первых, ориентируйся на кодификатор, во-вторых, разберись с помощью преподов или видео на YouTube, например, с каких тем стоит начать заниматься, а какие, наоборот, выгоднее оставить на потом. И внимательно следи за своей схемой — не отходи от нее, не изучай то, что находится в самом конце, если все еще пропущены разделы в середине. Иди по порядку — так гораздо выше шанс аккуратно уложить все в голове, чтобы не было проблем с пониманием.
Также помни: не зазубривай наизусть теорию — лучше уделить много времени, чтобы действительно понять почему вещества ведут себя подобным образом в реакциях. Эта дисциплина до ужаса логична — пойми пройденные процессы и тебе станет проще узнавать и выучивать новые.
Также уделяй внимание на изучение деталей, исключений, о которых даже не задумывался: ортофосфорная кислота является среднесильной, но в ЕГЭ считается слабой; а азотная кислота может восстанавливаться с образованием смеси продуктов, и только на основании логики можно выбрать верный ответ. Большинство таких ситуаций уже давно известны, поэтому советуем найти несколько видосов на YouTube, чтобы получше узнать все похожие ситуации. Плюс такие видео очень полезны для самоподготовки — у тебя есть кайфовые бесплатные материалы, так еще и с объяснением шарящих людей.
Пособия, которые тебе скорее всего пригодятся:
- Теория: «Репетитор по химии. Под редакцией — Егорова А.С.»;
- Практика: «Химия. Тематический тренинг. В.Н. Доронькин».
Их советуют преподаватели, так что точно не прогадаешь, если соберешься покупать.
Сборники же советуют выбирать от составителей, например, Д.Ю. Добротина. Конечно, их обязательно прорешивать, также веди статистику правильных решений и неверных, чтобы понимать, где у тебя сильное проседание, а где у тебя всегда верные ответы. Не переживай слишком сильно из-за ошибок: сделаешь множество дома — выше результат будет на реальном экзамене. Если запомнишь все свои недочеты, то в самой аудитории точно не допустишь их повторно. Главная проблема — стресс и паника. Они заставляют тебя потеряться и забыть все, что делал дома, в школе. Научись бороться с ними — лучший способ: ходи на любые олимпиады. Абсолютно не обязательно ходить именно по предмету: если это будет русский, математика или даже физическая культура — неважно, у тебя все равно будет новый опыт в стрессовой ситуации, особенно на более высоких этапах, чем школьный.