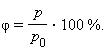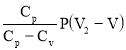ЕГЭ 2010, Физика, Подготовительный курс, Решение задач, Разбор реальных экзаменационных заданий, Касаткина И.Л., 2008.
В пособии кратко изложен весь курс физики средней школы. Приведены основные законы и формулы, показаны особенности их применения на отдельных примерах. Даны ответы на множество качественных вопросов, встречающихся в тестах части А и показано решение задач средней и повышенной трудности частей В и С Единого государственного экзамена (ЕГЭ) по физике. Для проверки знаний приведены 5 проверочных экзаменов типа ЕГЭ по разным разделам курса физики и ко всем даны пояснения и решения.
Пособие незаменимо при подготовке к ЕГЭ по физике. Оно может быть полезным учащимся старших классов школ, лицеев, гимназий и колледжам, а также абитуриентам и лицам, занимающимся самообразованием.
Виды прямолинейного движения.
Равномерное прямолинейное движение — это движение с постоянной скоростью.
Формулы равномерного и прямолинейного движения — это формулы 1) и 2).
На рис. 1, 2 и 3 представлены графики координаты, пути и скорости равномерного движения.
На графиках координаты и пути равномерного движения скорость численно равна тангенсу угла наклона графика к оси времени. На графике скорости равномерного движения путь численно равен площади прямоугольника, ограниченного самим графиком, осью времени и перпендикулярами, восстановленными из точек, соответствующих начальному и конечному моментам времени движения.
Равноускоренное движение — это движение с постоянным ускорением.
К формулам равноускоренного движения относятся формулы 3) -10).
Графики координаты, пути и скорости равноускоренного движения представлены на рис. 4, 5 и 6.
Графики координаты и пути равноускоренного движения представляют собой ветви параболы. Та парабола, которая ближе к оси координат или к оси путей, соответствует большему ускорению. На графиках координаты и пути скорость численно равна тангенсу угла наклона к оси времени прямой линии, проведенной касательно параболе. Если такая касательная линия параллельна оси времени, значит, в этот момент скорость стала равна нулю.
Содержание
Вступление
Раздел I. Механика
Тема 1. Кинематика
A. Виды прямолинейного движения
Б. Свободное падение
B. Относительность движения
Г. Равномерное движение по окружности. Проверочный экзамен по теме 1. «Кинематика»
Ответы на задания проверочного экзамена по теме 1. «Кинематика»
Тема 2. Динамика. Законы сохранения.
Статика
А. Законы Ньютона
Б. Законы сохранения. Статика
Проверочный экзамен по теме 2. «Динамика. Законы сохранения. Статика»
Ответы на задания проверочного экзамена по теме 2. «Динамика. Законы сохранения. Статика»
Раздел II. Гидродинамика. Молекулярная физика. Термодинамика
Тема 3. Гидродинамика
Тема 4. Молекулярная физика
Тема 5. Термодинамика
Проверочный экзамен по разделу II. «Гидродинамика. Молекулярная физика.
Термодинамика»
Ответы на задания проверочного экзамена по разделу II. «Гидродинамика.
Молекулярная физика. Термодинамика».
Раздел III. Электромагнетизм
Тема в. Электростатика
Тема 7. Законы постоянного тока
Тема 8. Магнетизм
Проверочный экзамен к разделу III. «Электромагнетизм»
Ответы на задания проверочного экзамена к разделу III. «Электромагнетизм»
Раздел IV. Колебания и волны. Оптика. Теория относительности. Физика атома
Тема 9. Колебания и волны
А. Механические колебания и волны
Б. Электромагнитные колебания и волны
Тема 10. Оптика
А. Геометрическая оптика
Б. Волновая и квантовая оптика
Тема 11. Теория относительности. Физика атома
А. Теория относительности
Б. Физика атома
Проверочный экзамен по разделу IV. «Колебания и волны. Оптика.
Теория относительности. Физика атома»
Ответы на задания проверочного экзамена по разделу IV. «Колебания и волны. Оптика. Теория относительности. Физика атома»
ПРИЛОЖЕНИЕ
Некоторые приставки для преобразования
внесистемных единиц в СИ
Перевод некоторых единиц в СИ
Некоторые сведения из математики
Основные формулы физики (теперь все вместе).
Бесплатно скачать электронную книгу в удобном формате, смотреть и читать:
Скачать книгу ЕГЭ 2010, Физика, Подготовительный курс, Решение задач, Разбор реальных экзаменационных заданий, Касаткина И.Л., 2008 — fileskachat.com, быстрое и бесплатное скачивание.
Скачать pdf
Ниже можно купить эту книгу по лучшей цене со скидкой с доставкой по всей России.Купить эту книгу
Скачать книгу ЕГЭ 2010, Физика, Подготовительный курс, Решение задач, Разбор реальных экзаменационных заданий, Касаткина И.Л., 2008 — pdf — depositfiles.
Скачать книгу ЕГЭ 2010, Физика, Подготовительный курс, Решение задач, Разбор реальных экзаменационных заданий, Касаткина И.Л., 2008
— pdf — Яндекс.Диск.
Дата публикации: 03.09.2013 10:34 UTC
Теги:
ЕГЭ по физике :: физика :: Касаткина
Следующие учебники и книги:
- Интенсивный курс подготовки к ЕГЭ по физике, Касаткина И.Л., 2012
- ЕГЭ 2013, Физика, Самое полное издание типовых вариантов заданий, Грибов В.А.
- ЕГЭ, Физика, Экспресс-подготовка, Немченко, Бальва, 2013
- ЕГЭ 2014, Физика, Самое полное издание типовых вариантов заданий, Грибов В.А., 2013
Предыдущие статьи:
- ЕГЭ по физике, Вариант 6, Центр, 2013
- ЕГЭ по физике, Вариант 6, Урал, 2013
- ЕГЭ по физике, Вариант 6, Сибирь, 2013
- ЕГЭ по физике, Вариант 6, Дальний Восток, 2013
Тест
к разделу «Основы молекулярной физики и термодинамики»
1.
Назовите вариант ответа, в котором представлены основные положения
Молекулярно-Кинетической Теории строения вещества….
1) все вещества состоят из молекул,
молекулы движутся непрерывно и хаотично
2) молекулы притягиваются и
отталкиваются
3) все вещества состоят из молекул,
молекулы притягиваются и отталкиваются, молекулы движутся непрерывно и хаотично
2.
Броуновское движение – это…
1)
Проникновение молекул одного вещества в промежутки между молекулами другого
вещества
2)
Отрыв молекул с поверхности жидкостей или твердых тел
3)
Хаотическое тепловое движение взвешенных частиц в жидкостях или газах
3. Физическая
величина, определяемая числом структурных элементов, содержащихся в системе,
называется…
1) Молярной массой. 2) Относительной молекулярной
массой.
3) Количеством вещества.
4. В
молекулярной физике используется понятие «идеальный
газ». Это понятие применимо тогда, когда можно пренебречь:
1)
Потенциальной энергией частиц.
2)
Кинетической энергией частиц.
3)
Потенциальной энергией частиц и их размерами.
5.
Какая величина характеризует состояние термодинамического равновесия?
1) давление 2) объём
3) температура
6.
Температура, при которой прекращается тепловое движение молекул, равна…
1)
273 К 2) 0 0С 3) 0
К
7.
К термодинамическим параметрам состояния идеального газа относятся …
1)
Объем, давление и молярная масса. 2) Температура, объем, давление. 3)
Температура, объем, масса.
8.
Давление газа обусловлено…
1)
Прилипанием молекул к стенкам сосуда 2) Столкновением молекул со
стенками сосуда 3) Столкновением молекул газа друг с другом
9.
Единица измерения давления газа в Международной системе — …
1)
Кельвин 2) Джоуль 3) Паскаль
10.
Изотермический процесс протекает при……
1)
постоянной температуре 2) постоянном давлении 3) постоянном объеме
11.
Процесс, при котором давление газа не меняется, называется…..
1)
адиабатным 2) изобарным 3) изохорным
12.
Процесс, при котором объем газа не меняется, называется…..
1) адиабатным 2)
изобарным 3) изохорным
13. Испарение
— это переход вещества из ….
1) Жидкого состояния в газообразное. 2)Твердого
состояния в жидкое.
3) Газообразного состояния в жидкое.
14.
Испарение происходит…
1)
при любой температуре. 2) при температуре кипения.
3)
при определенной температуре для каждой жидкости.
15.
При увеличении температуры жидкости скорость испарения…
1) уменьшается. 2)
увеличивается. 3) не изменяется.
16.
При испарении из жидкости вылетают….
1) молекулы с большой кинетической
энергией
2) молекулы с маленькой кинетической
энергией
3) любые молекулы из всей жидкости
17.
При испарении жидкость…..
1) имеет постоянную
температуру 2) охлаждается 3) нагревается
18. Конденсация — это процесс
перехода вещества из …состояние.
1) Жидкого в
газообразное 2) Твердого в жидкое 3) Газообразного в жидкое
19.
Пар, находящийся в динамическом равновесии со своей жидкостью называется….
1)
ненасыщенный 2) насыщенный 3) стабильный
20.
Влажность воздуха это…..
1)
содержание в воздухе различных газов 2) содержание в воздухе
частиц пыли 3) содержание в воздухе водяных паров
21.
Кристаллические твердые тела отличаются от аморфных ……
1)
формой 2) блеском
3) объемом
22.
К кристаллическим телам относится…..
1)
алмаз 2) сахарный леденец 3) графит
23.
К аморфным телам относится…..
1)
алмаз 2) сахарный леденец 3) графит
24.
Деформация твердых тел происходит если….
1)
под действием силы изменяется температура тела
2)
под действием силы изменяется цвет тела
3)
под действием силы изменяется форма или размер тела
25.
Твердое тело восстанавливает форму после снятия действия силы, это…..
1)
деформация упругая 2) деформация пластическая 3) деформация
хрупкая
26. Пластичность
— это свойство твердого тела, при котором
…
1) Исчезает деформация после прекращения действия сил.
2)
Сохраняется деформация
после прекращения действия сил.
3) При небольших деформациях происходит разрушение.
27.
Сопротивляемость материала упругой деформации характеризуется…
1) модулем упругости (Юнга) 2)
гравитационной постоянной 3) электрической постоянной
28.
Внутренняя энергия любого тела определяется …
1)
Кинетической энергией хаотического движения молекул.
2)
Потенциальной энергией взаимодействия молекул.
3)
Энергией движения и взаимодействия молекул.
29.
Внутренняя энергия макроскопических тел зависит…
1)
только от температуры 2) от температуры и объема
3)
только от объема
30. Каким
способом можно изменить внутреннюю энергию тела?
1) Только
совершением работы. 2) Только теплопередачей.
3)
Совершением работы и теплопередачей. 4) Внутреннюю энергию тела
изменить нельзя.
31.Каким
способом осуществляется передача энергии от Солнца к Земле?
1) Теплопроводностью. 2) Излучением. 3) Конвекцией.
4) Работой.
32. Как
обогревается комната радиатором центрального отопления?
1) Тепло
выделяется радиатором и распределяется по всей комнате.
2)
Обогревание комнаты осуществляется только за счет явления теплопроводности.
3)
Обогревание комнаты осуществляется только путем конвекции.
4) Энергия от
батареи теплопроводностью передается холодному воздуху у ее поверхности. Затем
конвекцией распределяется по всей комнате.
33.
Как изменяется внутренняя энергия тела при его охлаждении?
1)
увеличивается 2) уменьшается 3) не изменяется
34.Каким
способом можно точнее определить температуру горячей воды в стакане?
1) Опустить
термометр в воду, быстро его вынуть и снять показания.
2) Опустить
термометр в воду и быстро снять показания, не вынимая термометр из воды.
3) Опустить
термометр в воду, дождаться, когда его показания перестанут изменяться, и снять
показания, не вынимая его из воды.
4) Опустить
термометр в воду, подождать 10 — 15 мин и снять показания, не вынимая термометр
из воды.
35. В Международной
системе единица теплоты:
1)
Джоуль 2)
Ньютон 3)
Ватт 4)
Кельвин
36.
Кельвин является единицей:
1)
количества теплоты. 2)
теплоёмкости 3)
абсолютной
температуры
37. Ниже
приведены четыре утверждения. Какое из них выражает смысл первого закона
термодинамики?
1) Нельзя построить самый лучший на все времена двигатель.
Пройдет время, и будет создан еще лучший двигатель, чем сделан сейчас.
2) Невозможно «вечное движение» ни в природе, ни в технике.
Любые тела без действия внешних сил спустя некоторое время останавливаются.
3) Нельзя построить машину, которая совершала бы полезную работу
без потребления энергии извне и без каких-либо изменений внутри машины.
4) Нельзя построить двигатель, который работал бы вечно, так как
любая машина со временем изнашивается и ломается.
38.
Тепловые двигатели это….
1)
устройства, преобразующие электрическую энергию в механическую
2)
устройства, преобразующие световую энергию в механическую
3)
устройства, преобразующие энергию топлива в механическую
39.
Тепловой двигатель состоит из…..
1)
нагревателя и холодильника 2) рабочего тела и холодильника
3)
рабочего тела, нагревателя и холодильника
40. КПД идеальной тепловой машины
зависит
1) от
температуры холодильника, температуры нагревателя и рода рабочего тела
2) только
от рода рабочего тела 3) только от температуры холодильника
4) только от температуры холодильника
и температуры нагревателя
|
Основы молекулярно-кинетической теории и |
|||||||||||||||||||||||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
|
3 |
1 |
3 |
1 |
3 |
3 |
2 |
2 |
3 |
1 |
2 |
3 |
1 |
1 |
2 |
1 |
2 |
3 |
2 |
3 |
1 |
1 |
2 |
3 |
1 |
2 |
1 |
3 |
2 |
3 |
2 |
4 |
2 |
3 |
1 |
3 |
3 |
3 |
3 |
4 |
Добавил:
Valeriya
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Липецкий государственный технический университет
Предмет:
Физика
Файл:
.doc
Скачиваний:
217
Добавлен:
20.06.2014
Размер:
1.23 Mб
Скачать
☆
Молекулярная
физика и термодинамика.
Задание №1
Задание №2
Задание №3
Задание №4
Задание №5
Задание №6
Задание №7
Задание №8
Задание №9
Задание №10
Задание №11
Задание №12
Задание №13
Задание №14
Задание №15
Задание №16
Задание №17
Задание №18
Задание №19
Задание №20
Задание №21
Задание №22
Задание №23
Задание №24
Задание №25
Задание №26
Задание №27
Соседние файлы в папке Все тесты по физике + ответы
- #
20.06.20141.69 Mб214Волновая и квантовая оптика 2.doc
- #
20.06.20141.06 Mб153Квантовая физика и физика атома 2.doc
- #
20.06.2014967.68 Кб184Колебания и волны 2.doc
- #
20.06.20141.99 Mб187Механика2.doc
- #
20.06.20141.23 Mб217Молекулярная физика и термодинамика 2.doc
- #
20.06.2014121.34 Кб269Ответы к тестам.doc
- #
20.06.2014386.05 Кб156Постоянный ток 2.doc
- #
20.06.20141.98 Mб316Электричество и магнетизм 2.doc
- #
20.06.20141.07 Mб173Электростатика2.doc
- #
20.06.2014503.3 Кб150Элементы ядерной физики и физики ядерных частиц2.doc
Ставлю 10/10
Все нравится, очень удобный сайт, помогает в учебе. Кроме этого, можно заработать самому, выставляя готовые учебные материалы на продажу здесь. Рейтинги и отзывы на преподавателей очень помогают сориентироваться в начале нового семестра. Спасибо за такую функцию. Ставлю максимальную оценку.
Отлично
Лучшая платформа для успешной сдачи сессии
Познакомился со СтудИзбой благодаря своему другу, очень нравится интерфейс, количество доступных файлов, цена, в общем, все прекрасно. Даже сам продаю какие-то свои работы.
Отлично
Студизба ван лав ❤
Очень офигенный сайт для студентов. Много полезных учебных материалов. Пользуюсь студизбой с октября 2021 года. Серьёзных нареканий нет. Хотелось бы, что бы ввели подписочную модель и сделали материалы дешевле 300 рублей в рамках подписки бесплатными.
Отлично
Отличный сайт
Лично меня всё устраивает — и покупка, и продажа; и цены, и возможность предпросмотра куска файла, и обилие бесплатных файлов (в подборках по авторам, читай, ВУЗам и факультетам). Есть определённые баги, но всё решаемо, да и администраторы реагируют в течение суток.
Отлично
Маленький отзыв о большом помощнике!
Студизба спасает в те моменты, когда сроки горят, а работ накопилось достаточно. Довольно удобный сайт с простой навигацией и огромным количеством материалов.
Хорошо
Студ. Изба как крупнейший сборник работ для студентов
Тут дофига бывает всего полезного. Печально, что бывают предметы по которым даже одного бесплатного решения нет, но это скорее вопрос к студентам. В остальном всё здорово.
Отлично
Спасательный островок
Если уже не успеваешь разобраться или застрял на каком-то задание поможет тебе быстро и недорого решить твою проблему.
Отлично
Всё и так отлично
Всё очень удобно. Особенно круто, что есть система бонусов и можно выводить остатки денег. Очень много качественных бесплатных файлов.
Отлично
Отзыв о системе «Студизба»
Отличная платформа для распространения работ, востребованных студентами. Хорошо налаженная и качественная работа сайта, огромная база заданий и аудитория.
Хорошо
Отличный помощник
Отличный сайт с кучей полезных файлов, позволяющий найти много методичек / учебников / отзывов о вузах и преподователях.
Отлично
Отлично помогает студентам в любой момент для решения трудных и незамедлительных задач
Хотелось бы больше конкретной информации о преподавателях. А так в принципе хороший сайт, всегда им пользуюсь и ни разу не было желания прекратить. Хороший сайт для помощи студентам, удобный и приятный интерфейс. Из недостатков можно выделить только отсутствия небольшого количества файлов.
Отлично
Спасибо за шикарный сайт
Великолепный сайт на котором студент за не большие деньги может найти помощь с дз, проектами курсовыми, лабораторными, а также узнать отзывы на преподавателей и бесплатно скачать пособия.
Отлично

ЕГЭ-2013. Физика : тематические и типовые экзаменационные варианты : 32 варианта / под ред. М. Ю. Демидовой. — М., 2012. — 272 с, — (ЕГЭ-2013. ФИПИ — школе).
Серия «ЕГЭ-2013. ФИПИ — школе» подготовлена разработчиками контрольных измерительных материалов. В сборнике представлены:
• 22 тематических варианта по всем разделам кодификатора ЕГЭ;
• 10 обновлённых типовых экзаменационных вариантов для подготовки к экзамену 2013 года;
• инструкция по выполнению экзаменационной работы и типовые бланки ответов ЕГЭ;
• ответы ко всем заданиям;
• критерии оценивания.
Тематические варианты представлены тренировочными и итоговыми вариантами работ, что предоставляет возможность систематической подготовки к ЕГЭ.
Выполнение заданий типовых экзаменационных вариантов позволяет учащимся объективно оценить уровень своей подготовки.
Учителя могут использовать представленные варианты для организации контроля результатов обучения школьников.
СОДЕРЖАНИЕ
Введение 4
Спецификация тематических тренировочных вариантов 6
Справочные данные 7
ТЕМАТИЧЕСКИЕ ТРЕНИРОВОЧНЫЕ ВАРИАНТЫ
РАЗДЕЛ 1. МЕХАНИКА 9
Вариант 1.1. «Кинематика», «Динамика» 9
Вариант 1.2. «Кинематика», «Динамика» 15
Вариант 1.3. «Законы сохранения в механике» 18
Вариант 1.4. «Законы сохранения в механике» 24
Вариант 1.5. «Статика» 27
Вариант 1.6. «Колебания и волны» 33
Итоговый вариант 1. «Механика» 39
Итоговый вариант 2. «Механика» 47
РАЗДЕЛ 2. МКТ И ТЕРМОДИНАМИКА 55
Вариант 2.1. «Молекулярная физика» 55
Вариант 2.2. «Термодинамика» 61
Вариант 2.3. «МКТ и термодинамика» 68
Вариант 2.4. «МКТ и термодинамика» 71
Итоговый вариант 3. «Механика», «МКТ и термодинамика» 74
Итоговый вариант 4. «Механика», «МКТ и термодинамика» 83
РАЗДЕЛ 3. ЭЛЕКТРОДИНАМИКА 92
Вариант 3.1. «Электростатика», «Постоянный ток», «Магнитное поле» 92
Вариант 3.2. «Электростатика», «Постоянный ток», «Магнитное поле» 98
Вариант 3.3. «Электромагнитная индукция», «Электромагнитные колебания», «Оптика» . . 101
Вариант 3.4. «Электромагнитная индукция», Электромагнитные колебания», «Оптика» . . . 108
Итоговый вариант 5. «Механика», «МКТ и термодинамика», «Электродинамика» 111
Итоговый вариант 6. «Механика», «МКТ и термодинамика», «Электродинамика» 121
РАЗДЕЛ 4. КВАНТОВАЯ ФИЗИКА 130
Вариант 4.1. «Квантовая физика» 130
Вариант 4.2. «Квантовая физика» 137
ТИПОВЫЕ ЭКЗАМЕНАЦИОННЫЕ ВАРИАНТЫ
Инструкция по выполнению работы 140
Вариант 1 143
Вариант 2 151
Вариант 3 158
Вариант 4 165
Вариант 5 172
Вариант 6 180
Вариант 7 187
Вариант 8 194
Вариант 9 201
Вариант 10 209
ОТВЕТЫ К ТЕМАТИЧЕСКИМ ТРЕНИРОВОЧНЫМ ВАРИАНТАМ 217
ОТВЕТЫ К ТИПОВЫМ ЭКЗАМЕНАЦИОННЫМ ВАРИАНТАМ 246
Вопросы для подготовки к зачету по теме «Основы молекулярной физики и термодинамика»
14. Основные положения МКТ. Диффузия и броуновское движение.
15. Размеры и масса молекул. Количество вещества. Молярная масса. Число Авогадро.
16. Идеальный газ, его основные свойства. Давление газа, единицы давления.
17. Парообразование и конденсация. Испарение. Кипение.
18. Насыщенный пар и его свойства. Влажность воздуха и ее измерение.
19. Поверхностное натяжение жидкости. Коэффициент поверхностного натяжения жидкости. Явления смачивания и не смачивания. Краевой угол.
20. Понятия кристаллического и аморфного тел. Виды кристаллических решёток. Плавление и кристаллизация твёрдых тел.
Ответы.
Часть 1. Основные физические величины, единицы их измерения, формулы для нахождения.
Часть 2. Основные понятия.
1. Основные положения МКТ.
- Все тела состоят из мельчайших частиц – атомов, молекул, между которыми есть промежутки. Строение любого вещества дискретно (прерывисто).
- Атомы и молекулы вещества находятся в непрерывном хаотическом движении.
- Между частицами любого вещества существуют силы взаимодействия – притяжения и отталкивания. Природа этих сил электромагнитная.
Диффузией называют явление самопроизвольного проникновения молекул одного вещества в промежутки между молекулами другого. Т.е. это самопроизвольное перемешивание веществ.
Броуновское движение — тепловое движение взвешенных в жидкости (или газе) частиц.
4. Молекула. Размеры и масса молекул.
Молекулой называют наименьшую устойчивую частицу данного вещества, обладающую его основными химическими свойствами.
Размеры молекул очень малы.
Порядок величины диаметра молекулы 1*10—8 см = 1*10—10 м
Порядок величины объёма молекулы 1*10—20 м3
Порядок величины массы молекул 1*10-23 г = 1*10-26кг
Количество вещества ע – это физическая величина, показывающая, во сколько раз число молекул в данном веществе больше, чем число атомов в 12 г углерода. Оно равно отношению числа молекул (атомов) (N) в данном макроскопическом теле к числу молекул в 12 г углерода (NA)
Единица измерения — 1 моль
Молярная масса — масса вещества, взятого в количестве 1 моль.
M=m0·NA
Единица измерения — 1 кг/моль.
Значение молярной массы для каждого элемента можно узнать в таблице Менделеева.
Один моль любого вещества содержит одинаковое число молекул.
Постоянная Авогадро — число молекул в 1 моле любого вещества.
NA =6, 02 * 1023моль -1
8. Идеальный газ, его свойства.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ.
Свойства идеального газа:
- расстояние между молекулами много больше размеров молекул;
- молекулы газа очень малы и представляют собой упругие шары;
- силы притяжения между молекулами стремятся к нулю;
- взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
- молекулы этого газа двигаются беспорядочно;
- движение молекул происходит по законам Ньютона.
9. Давление газа, единицы давления.
Давление – физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
p = F/S Единица давления в СИ паскаль [Па]
Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
10. Парообразование и конденсация.
Парообразование — переход вещества из жидкого состояния в газообразное.
Происходит двумя путями: испарением и кипением.
Конденсация — переход вещества из газообразного состояния в жидкое.
Для того, чтобы превратить в пар при неизменной температуре жидкость массой m, ей необходимо сообщить количество теплоты, равное Qп = L·m
L – удельная теплота парообразования
При конденсации выделяется количество теплоты, равное Qк = — L·m
Испарение — это парообразование, происходящее со свободной поверхности жидкости.
Скорость испарения зависит:
- от рода жидкости (эфир и вода);
- от площади её свободной поверхности (чем больше площадь, тем быстрее испаряется жидкость – блюдце и стакан);
- от температуры (чем выше температура, тем быстрее испаряется жидкость – лужи зимой и летом);
- от наличия движения воздуха над поверхностью (в ветреную погоду и в безветренную).
Кипение — это парообразование, которое происходит в объеме всей жидкости при постоянной температуре.
12. Насыщенный пар и его свойства.
Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным.
Свойства насыщенного пара:
1. Концентрация молекул насыщенного пара не зависит от его объёма при постоянной температуре. Если уменьшить объем насыщенного пара, то сначала концентрация его молекул увеличится и из газа в жидкость начнет переходить больше молекул до тех пор, пока опять на установится динамическое равновесие.
2. Давление насыщенного пара при постоянной температуре не зависит от его объёма.
p = n·k·T, т.к. n не зависит от V , то и р не зависит от V.
Независимое от объёма давление пара, при котором жидкость находится в равновесии со своим паром, называется давлением насыщенного пара. Это наибольшее давление, которое может иметь пар при данной температуре.
3. Давление насыщенного пара зависит от температуры. Чем выше будет температура жидкости, тем больше молекул будет испаряться, динамическое равновесие нарушится, но концентрация молекул пара будет расти до тех пор, пока равновесие не установится опять, а значит, больше станет и давление насыщенного пара. С увеличением температуры давление насыщенных паров возрастает.
13. Влажность воздуха и ее измерение.
Воздух, содержащий водяной пар, называют влажным.
Абсолютная влажность – величина, показывающая, какая масса паров воды находится в 1 м³ воздуха. Она равна парциальному давлению пара при данной температуре.
Парциальное давление пара – это давление, которое оказывал бы водяной пар, находящийся в воздух , если бы все остальные газы отсутствовали.
Относительная влажность воздуха – это величина, показывающая, как далек пар от насыщения. Это отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара p0 при той же температуре, выраженное в процентах:
Для измерения влажности воздуха используют приборы гигрометры и психрометры.
14. Поверхностное натяжение жидкости. Коэффициент поверхностного натяжения жидкости.
Чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил Aвнеш, пропорциональную изменению ΔS площади поверхности:
Aвнеш = σΔS
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0) или просто поверхностным натяжением.
σ = А/ΔS
Коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
Коэффициент поверхностного натяжения σ зависит
- от рода жидкости;
- от наличия примесей;
- от температуры.
Поверхностное натяжение это физическая величина, равная отношению силы поверхностного натяжения F, приложенной к границе поверхностного слоя жидкости и направленной по касательной к поверхности, к длине L этой границы.
σ = Fк / L
15. Явления смачивания и не смачивания. Краевой угол.
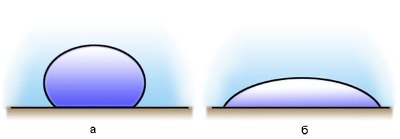
Если капли воды поместить на поверхность чистого стекла, то они будут растекаться, а если на жирную поверхность, то они примут форму, близкую к форме шара.
Если силы взаимодействия молекул жидкости с молекулами твердого тела больше сил взаимодействия между молекулами самой жидкости, то жидкость смачивает поверхность твердого тела. (случай с каплями воды на стекле)
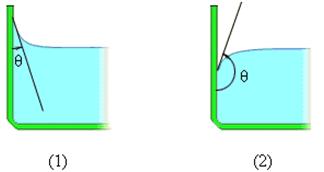
В этом случае жидкость подходит к поверхности твердого тела под некоторым острым углом θ, характерным для данной пары жидкость – твердое тело. Угол θ называется краевым углом.
Краевой угол – угол между поверхностью твердого тела и касательной к поверхности жидкости в точке соприкосновения.
Краевые углы смачивающей (1) и несмачивающей (2) жидкостей.
Если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела, то жидкость не смачивает поверхность твердого тела. (случай с каплями воды на жирной поверхности, ртутью на стекле)
В этом случае краевой угол θ оказывается тупым (рис. 1).
При смачивании θ < 0 (острый), при несмачивании θ > 0 (тупой). При полном смачивании θ = 0, при полном несмачиванииθ = 180°.
16. Понятия кристаллического и аморфного тел.
Твёрдые тела — вещества, длительное время сохраняющие свою форму и объём.
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – кристаллические и аморфные тела.
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества.
Молекулы и атомы в аморфных телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Для аморфных тел, как и для жидкостей, характерен ближний порядок в расположении частиц, но, в отличие от жидкостей, подвижность частиц мала. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), воск, смола, пластики и т. д.
17. Виды кристаллических решёток.
В зависимости от характера сил взаимодействия и природы частиц, находящихся в узлах кристаллической решетки, различают четыре типа кристаллических решеток.
1. Ионные кристаллы. В узлах кристаллической решетки находятся ионы (положительно и отрицательно заряженные) атомов, которые входят в состав молекулы данного вещества. Связь между ними обусловлена электрическими (кулоновскими) силами взаимодействия (притяжения) между разноименными ионами.
Примером ионной решетки служит кристалл каменной соли NaCl.
2. Атомные кристаллы. В узлах кристаллической решетки находятся нейтральные атомы. Между ними существует ковалентная связь (связь, при которой каждые два соседних атома удерживаются рядом силами притяжения, возникающими при взаимном обмене между этими атомами двумя валентными электронами).
Примером атомных кристаллов являются алмаз, графит, германий, кремний.
3. Молекулярные кристаллы. В узлах кристаллической решетки находятся молекулы, ориентированные определенным образом. Между молекулами действуют силы притяжения, характерные для взаимодействия молекул.
К молекулярным кристаллам относятся нафталин, парафин, сухой лед СО2, лед Н2О.
4. Металлические кристаллы. В узлах кристаллической решетки находятся положительные ионы металла, между которыми движутся свободные (валентные) электроны, образующие электронный газ. Связь в металлических кристаллах обеспечивается силами притяжения между положительными ионами, находящимися в узлах решетки, и отрицательным электронным газом.Эти силы притяжения уравновешиваются силами отталкивания между одноименными ионами.
18. Плавление и кристаллизация твёрдых тел.
Плавление – переход вещества из твердого состояния в жидкое.
При плавлении температура тела остается постоянной. Все переданное телу тепло идет на разрушение кристалла.
Чтобы перевести в жидкость твердое тело массой m при температуре плавления, ему надо сообщить количество теплоты
Q = λ m
где λ – удельная теплота плавления.
Кристаллизация (отвердевание) – переход вещества из жидкого состояния в твердое
При кристаллизации происходит выделение количества теплоты
Q = -λ m
19. Первый закон термодинамики.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Q = ΔU + A.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Ниже приведены условия и решения задач. Закачка решений в формате doc начнется автоматически через 10 секунд.
№ 514.
Определить молярную массу газа, если при температуре Т=300 К и давлении p=0,2 МПа он имеет плотность ρ=2,41 кг/м3.
Дано : T= 300 K
P= 2×105 Па
ρ=2,41 кг/м3
Найти: Решение.
Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, записанного в виде:
P= (1) , где ρ – плотность газа; R – молярная газовая постоянная (R =8.31 Дж/(моль∙К)) ; T – температура газа ; P – давление газа ; μ – молярная масса газа.
Выражая из (1) молярную массу μ, получим :
= (3)
Подставляя, заданные числовые значения физических величин в формулу (3) и вычисляя, получим :
==0,03 кг/моль
Ответ : =0,03 кг/моль.
№ 524
Найти отношения теплоёмкостей Cp/Cv для газовой смеси, состоящей из 10 г гелия и 25 г водорода?
Дано: газ He
газ Н2
ν1= m1/M1 = 10/4 =2,5 моль
ν2= m2/M2 = 25/2 = 12,5 моль
Найти : Cp/Cv Решение.
Молярную теплоёмкость смеси Cv при постоянном объёме найдём следующим. Теплоты, необходимую для нагревания смеси на ΔТ, выразим двумя способами :
Q=Cv(ν1+ν2)ΔT (1)
Q=(Cv1ν1+Cv2ν2)ΔT (2)
где Cv1 – молярная теплоёмкость гелия ; Cv2 – молярная теплоёмкость кислорода.
Приравняв правые части (1) и (2) и разделив обе части полученного равенства на ΔТ, получим :
Cv(ν1+ν2)=Cv1ν1+Cv2ν2 , откуда
Cv=(Cv1ν1+Cv2ν2)/(ν1+ν2) (3)
Рассуждая так же, получим формулу для вычисления молярной теплоёмкости при постоянном давлении :
Cp=(Cp1ν1+Cp2ν2)/(ν1+ν2) (4)
Вычислим отношение формул (4) и (3), получим :
Cp/Cv=(Cp1ν1+Cp2ν2)/(Cv1ν1+Cv2ν2) (5)
Молярные теплоёмкости газа при постоянном объёме и давлении выражаются соответственно :
Cv=iR/2 ; Cp=(i+2)R/2 , где i – число степеней свободы молекулы газа.
Используя эти выражения запишем формулы для молярных теплоёмкостей гелия и кислорода.
Сv1=i1R/2 (6) ; Cp1=(i1+2)R/2 (7) ,где i1=3 (так как молекула гелия одноатомная).
Сv2=i2R/2 (8) ; Cp2=(i2+2)R/2 (9) , где i2=5 (так как молекула водорода двухатомная).
Подставляя, полученные выражения (6), (7), (8) и (9) в формулу (5), получим :
Cp/Cv=[(i1+2)ν1+(i2+2)ν2]/(i1ν1+i2ν2) (10)
Произведя вычисления, получим :
Cp/Cv=[(3+2)∙2,5+(5+2)∙12,5]/(3∙2,5+5∙12,5)= 1,4286 Дж/(К моль)
Ответ : Cp/Cv=1,4286 Дж/(К моль).
№534
Найти среднюю длину свободного пробега молекулы азота в сосуде объемом 6 л. Масса газа 0,5 г.
Дано : d=3×10-8 см=3×10—11 см
p=105 Па
T=273 K
Найти :
Решение.
Средняя длина свободного пробега молекул газа выражается формулой :
=1/
πd2n (1)
где d – диаметр молекулы ; n – концентрация молекул.
Концентрация молекул связана с давлением и температурой газа выражением:
n=p/kT (2)
где к – постоянная Больцмана (к=1.38×10-23 Дж/К)
Из уравнения Менделеева-Клайперона можем записать:
(3)
, где V – объем газа, R – молярная газовая постоянная, m и M – масса и молярная масса газа соответственно.
Подставляя (3) в (2), а затем в выражение (1), получим:
=
(4)
Вычисления по формуле (4) дают
=
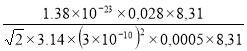
Ответ: =1,9336×10—3 м.
№ 546
Газ, для которого γ=Cp/Cv=4/3, находится под давлением P=2×105 Па и занимает объём V=3 дм3. В результате изобарического нагревания объём увеличился в 3 раза. Определить количество теплоты, переданное газу.
Дано : γ=Cp/Cv=4/3
P=2×105 Па
V=3 дм3=3×10—3 м3
V2/V=3
Найти : Q
Решение.
Количество теплоты, участвующее в изобарном процессе выражается формулой :
Q= (1) , где m – масса газа ; M – молярная масса газа ; Cp – молярная теплоёмкость при p=const ; ΔT – изменение температуры газа.
Изменение температуры газа :
ΔT=T2—T1 (2)
Начальную Т1 и конечную Т2 температуры газа найдём из уравнения Менделеева-Клапейрона :
T1= (3) ; T2=
(4)
где V и V2 – объёмы газа до нагревания и после, соответственно.
С учётом выражений (3) и (4), формула (2) примет вид :
ΔT= (5)
Подставляя полученное выражение для ΔТ согласно (5) в уравнение (1), получим :
Q= (6)
С учётом уравнения : R=Cp—Cv выражение (6) примет вид :
Q=
Разделив числитель и знаменатель последнего выражения на Cv и, учитывая, что V2=3V, получим :
Q=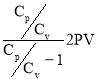
Произведя вычисления по формуле (7), найдём количество теплоты, подведённое к газу :
Q=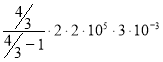
Ответ : Q=4.8 кДж.
№ 556
Во сколько раз необходимо увеличить объём ν=5 моль идеального газа при изотермическом расширении, если его энтропия увеличилась на ΔS=57.6 Дж/К?
Дано : ν=5 моль
T=const
ΔS=57.6 Дж/К
Найти : V2/V1
Решение.
Как известно, изменение энтропии выражается общей формулой :
ΔS=S2—S1= (1)
При вычислении по формуле (1) вынесем температуру Т за знак интеграла (при изотермическом процесс T=const). Вычислив интеграл, найдём :
ΔS=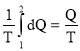
где Q – количество теплоты.
Количество теплоты при изотермическом процессе выражается формулой :
Q=νRTln(V2/V1) (3)
С учётом (2) уравнение (3) примет вид :
ΔS=
Отсюда изменение объёма газа :
V2/V1= (4)
Вычисления по формуле (4) дают :
V2/V1==4
Ответ : объём газа необходимо увеличить в 4 раза.